P-blok
III.A -> VIII.A
$ns^2np^1 \to ns^2np^6$
# Halogény
VII.A - $ns^2np^5$
F Cl Br I At
Vyskytujú sa vo forme dvojatómových molekúl:
$\ce{X-X \quad X2}$ -> kovalentná nepolárna väzba
Všetky halogény sú toxické.
Keďže sú nepolárné, tak sú veľmi málo rozpustné vo vode (polárne v polárnom)
Sú ale rozpustné v nepolárnych rozpúšťadlách (sírouhlík, benzén, toluén)
Skupenstvo:
$\ce{F2}$ - plyn
$\ce{Cl2}$ - plyn
$\ce{Br2}$ - červenohnedá kvapalina
$\ce{I2}$ - fialovočierna tuhá látka, podlieha sublimácii
Reaktivita:
Reaktivita klesá smerom dole (e.neg.)
F - 3.98
Cl - 3.16
Br - 2.96
I - 2.66
$\ce{2KBr + Cl2 -> 2KCl + Br2}$
$\ce{2KCl + Br2 \not\to}$
# Zlúčeniny
# Halogénvodíkové kyseliny
Vo forme roztoku, mimo vody sú plynné -> silne zapáchajúce, bezfarebné.
Sila stúpa smerom dole:
$\text{HF - kys. fluorovodíková (ag); fluorovodík (g)}$
$\text{HCl - kys. chlorovodíková (ag); chlorovodík (g)}$
$\text{HBr - kys. bromovodíková (ag)}$
$\text{HI - kys. jodovodíková (ag)}$
# Kyslíkaté kyseliny Cl
$\ce{HClO \quad HClO2 \quad HClO3 \quad HClO4}$
————————>
rast sily (pKa sa zmenšuje)
chlorečnany a chloristany na výrobu výbušnín - zdroj kyslíka
# Vznik halogenidov
A) Priame zlučovanie prvkov
$\ce{Cl2 + Fe -> FeCl2}$
B) Reakcia neušľachtilého kovu s kyselinou
$\ce{Zn + 2HCl -> H2 + ZnCl2}$
C) Reakcia kyseliny a hydroxidu
$\ce{NaOH + HCl -> NaCl + H2O}$
D) Roztok soli s kyselinou
$\ce{AgNO3 + HCl -> AgCl v + HNO3}$
E) Roztok soli s halogenidom
$\ce{PbNO3 + KI -> PbI2 + KNO3}$
# Vzácne plyny
VIII.A - $ns^2np^6$
Získavajú sa frakčnou destiláciou skvapalneného vzduchu
Do roku 1962 neboli známe žiadne zlúčeniny.
Najviac preskúmané zl.: $\ce{XeO3,H2XeO4,H2KrO4}$
He
Náplň balónov a vzducholodí, chladenie.
S O a N tvorí náplň tlakových fľaší -> heliox.Ne
Náplň svietidielAr
Najrozšírenejší vzácny plyn
Náplň medzi sklá okienXe
Osvetľovacie svetlá automobilov
Blesk fotoaparátovRa
Liečba nádorových ochorení
# Chalkogény
VI.A - $ns^2np^4$
O, S, Se, Te, Po
# Síra
Nadobúda oxidačné čísla IV, VI, I-I
Vyskytuje sa v kryštalických modifikáciach:
- dve najstabilnejšie tvorené cyklickými molekulami $S_8$ s rozličným usporiadaním.
Alotrópne formy síry - plastická síra a sírny kvet
Zahrievanie:
Tuhá síra sa mení na žltú kvapalinu. Zvyšovaním teploty hnedne a svyšuje viskozitu.
Molekuly $S_8$ sa štiepia a vznikajú dlhé reťazce $S_n$
Prudké ochladenie:
Kvapalná -> plastická síra
Plynná -> sírny kvet vo forme prášku
Kryštalická síra:
Žltá tuhá látka, nerozpustná vo vode.
Veľmi dobre rozpustná v nepolárnych rozpúšťadlách $CS_2$
Pri bežnej teplote je stála, pri zvýšení teploty sa reaktivita zvyšuje.
Priamo reaguje s viacerými prvkami:
- $\ce{8H2 + S8 -> 8H2S}$
- kovy + S -> sulfidy
- kyslík + S -> SO2
# Zlúčeniny

Sulfán - $\ce{H2S}$
Bezfarebný nepríjemne zapáchajúci plyn, ťažší ako vzduch
Veľmi toxický - viaže sa na ťažké kovy v enzýmoch a na železo v hemoglobíne
Dobre rozpustný vo vode -> slabá kyselina
Tvorí sulfidy a hydrogensulfidy
Má vždy redukčné účinky, lebo $S^{-II}$ je najnižšie oxidačné číslo síry
Príprava: $\ce{FeS + 2HCl -> FeCl2 + H2S}$
Zavádzaním do roztokov sa dajú pripraviť nerozpustné sulfidy -> analytická chémia
Oxid síričitý - $\ce{SO2}$
Vzniká pálením síry: $\ce{S + O2 -> SO2}$
Bezfarebný toxický plyn, leptá sliznicu, vyvoláva kašeľ.
Aj oxidovadlo, aj redukovadlo.
$\ce{2SO2 + O2 ->[V2O5] 2SO3} \quad \triangle H < 0$
Oxid sírový - $\ce{SO3}$
Plynná látka
Jedine oxidačné vlastnosti, lebo $S^{VI}$
Kyslina sírová - $\ce{H2SO4}$
Bezfarebná leptavá látka
Hygroskopická -> silné dehydratačné účinky (org. látky zuhoľnatejnú)
# Výskyt
# V.A skupina
$ns^2np^3$
N, P, As, Sb, Bi
# Dusík

Plyn ľahší ako vzduch. Tvorí stabilné molekuly N2
Oceľové nádoby sú označené čiernou farbou
# Bezkyslíkaté
Amoniak - $NH_3$
Vodný roztok = čpavok
Bezfarebný plyn s nepríjemným šťipľavým zápachom, leptá sliznicu.
$\ce{N2 + 3H2 ->[t, p] 2NH3}$ -> Haber-Boschova syntéza
$\ce{NH3 + HCl -> NH4+ + Cl- -> NH4Cl}$
$\ce{NH3 + H+ -> NH4+}$ -> donorno-akceptorná väzba
Salmiak - $NH_4Cl$
Náplň do batérií
Súčasť niektorých liečív
# Kyslíkaté
Oxid dusný - $N_2O$ - plyn, príjemná vôňa, inhalačná anestéza
Oxid dusnatý - $NO$ - bezfarebný plyn - $\ce{2NO + O2 -> 2NO2}$
Oxid dusičitý - $NO_2$ - dimér = $N_2O_4$
# Fosfor
3 hlavné alotrópy:
- biely fosfor $P_4$ (tetrafosfor)
- červený fosfor $P_n$ - dlhé reťazce tetrafosforu
- čierny fosfor - vrstevnatý
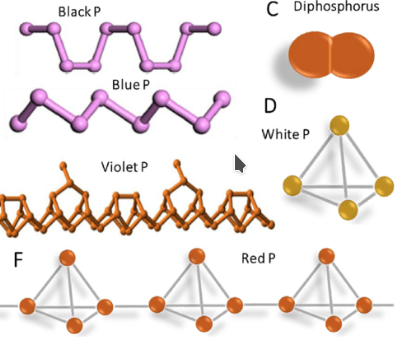
Najreaktívnejší = biely fosfor, pyroforický (samovznietivý), jedovatý, podlieha oxidácií:
$\ce{P4 ->[O2] P4O6}$ oxid fosforitý v dimérnej forme $\ce{->[O2] P4O10}$ oxid fosforečný v dimérnej forme
$\ce{P4O10 + 6H2O -> 4H3PO4}$ (hygroskopický, sušenie látok)
Kys trihydrogenforsforečná - $H_3PO_4$
Dôležitý biogenný prvok (ATP, DNA, RNA, enzýmy)
Pri výrobe priemyselných hnojív:
- $KH_2PO_4$
- $(NH_4)_2HPO_4$
# IV.A skupina
$ns^2np^2$
C, Si, Ge, Sn, Pd
# Uhlík
# Alotropy
# Grafit
Má šesťuholníkovú kryštalickú štruktúru - každý atóm spojený s 3ma ďalšími
Vrstvy sú usporiadané do vodorovných vrstiev držaných van der waals silami
Nerozpustný vo vode, vedie elek. prúd. Reaktívnejší než diamant.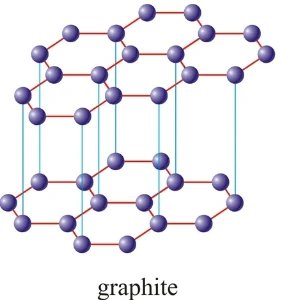
# Diamant
Atómy uhlíka sa viažu so 4ma ďalšími v pravidelnom tetraédri
Nerozpustný vo vode, nevedie el. prúd
Najtvrdšia prírodná látka (10 na Mohs stupnici)
Opracovaný diamant = briliant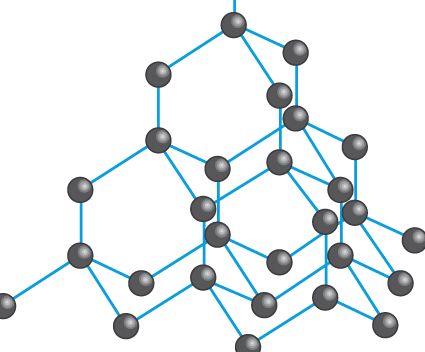
# Fulerény
C20, C40, C60
Usporiadané do tvaru futbalových lôpt.
Navzájom viazané van der waalsovými silami
Mäkké, nerozpustné vo vode, polovodiče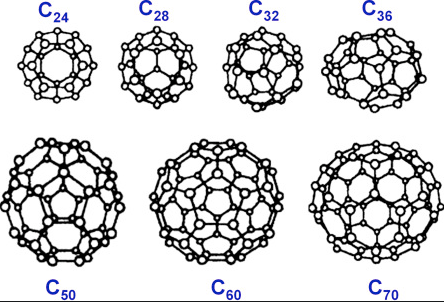
# Kyslíkaté
Oxid uhoľnatý - $CO$
Bezfarebný nehorľavý plyn, bez zápachu, ľahší než vzduch.
Krvný jed -> viaže sa na hemoglóbin.
Vzniká nedokonalím spaľovaním C: $\ce{2C(s) + O2(g) -> 2CO(g)}$
Oxid uhličitý - $CO_2$
Bezfarebný nehorľavý plyn, bez zápachu, ťažší než vzduch.
Rozpustný vo vode -> $\ce{CO2 + H2O -> H2CO3}$
Nie je toxický, ale je nedýchateľný
0,03% v atmosfére
V minerálnej vode, šumivých nápojoch, víne a pive.
$\ce{C + O2 -> CO2}$ -> dokonalé spaľovanie (dosť kyslíka)
$\ce{CaCO3 + 2HCl -> CaCl2 + H2O + CO2 ^}$
Využitie v hasiacich prístrojov
Tlakové nádoby so sivým pruhom
Tvorí suchý ľad $CO_2(s)$
Diamid kys. uhličitej - močovina - $CO(NH_2)_2$
Dichlorid kys. uhličitej - fosgén - $COCl_2$
# Bezkyslíkaté
Sulfid uhličitý - $CS_2$
Taktiež sírouhlík, je bezfarebná kvapalina príjemnej vône, prchavá a horľavá.
Dlhším státím zhnedne a získa nepríjemný zápach.
Silné toxické účinky -> poruchy mozgu a nervového systému
Nepolárne rozpúšťadlo, nerozpustný vo vode
Kys. kyanovodíková - $HCN$
Bezfarebná kvapalina horkomandľového zápachu.
Veľmi toxická - ochrnutie dýchacej a nervovej sústavykyanidy:
- vo vodnom roztoku silne hydrolyzujú
- CN- sa podobajú na X- -> pseudohalogenidy
- KCN - cyankáli veľmi toxický
# Krémik
Tmavosivá, tvrdá, krehká kryštalická látka
Štruktúrou podobný diamantu
Vytvára reťazce
- Si-Si < C-C
- Si-H < C-H
- Si-O > C-O
Tvorí silikóny/silikáty: R-Si
Je to polokov -> polovodič
Príprava: $\ce{SiO2 + 2C ->[t] Si + 2CO}$
Oxid kremičitý - $SiO_2$
V prírode sa vyskytuje ako kremeň - krištáľ
Výroba skla, nemôže sa v ňom uchovávať HF: $\ce{4HF + SiO2 -> SiF4 + 2H2O}$
Farebné odvody:
- ametyst - fialový
- záhneda - hnedý
- citrín - žltý
$\ce{Na2SiO3, K2SiO3}$ = vodné sklo
$\ce{CaSiO3}$ = základná zložka cementu
# III.A skupina
$ns^2np^1$
B, Al, Ga, In, Tl
polokov kovy
# Hliník
$\ce{Al^0 - 3e- -> Al^{III}}$
Ľahký, striebrobiely, mäkký kov
3. najrozšírenejší prvok v Zemskej kôre (1. kov)
V zliatinach s Cu, Mg, Mn, Si, Sn, Zn
Dural - zliatina Al, Cu, Mg
Veľmi pevný -> konštrukcie bicyklov
Hlinitá ruda = bauxit - spracovanie v hlinikárni - Žiar nad Hronom
$\ce{AlO(OH) -> Al(OH)3 ->[t] Al2O3 ->[elektrolýza, t, Na3AlF6(kryolit)] Al}$
Kryolit znižuje teplotu tavenia
Hliník odoláva korózií - vytvára na povrchu vrstvičku hydroxidu a oxidu
Amfotérne vlastnosti:
$\ce{2Al +6H2O ->2Al(OH)3 +8H2}$
$\ce{2Al +3H2SO4 ->Al2(SO4)3 +2H2}$
$\ce{2Al +2NaOH +6H2O ->2Na[Al(OH)4] +3H2}$
Oxid hlinitý - $Al_2O_3$
Spaľovaním práškového hliníka: $\ce{4Al(s) +3O2(g) ->2Al2O3(s)} \quad \triangle H<0$
Dve modifikácie:
- $\alpha-Al_2O_3$
Bezfarebný mineraál korund
Tvrdý (9. stupeň na Mohs stup.)
Odrody sú známe drahokamy - rubín (Cr2O3), zafír (FeO, Fe2O3, TiO2)
Ťažko taviteľná látka, nerozpustná. - $\gamma-Al_2O_3$
Rozpustný v roztokoch kys. a hydrox.
Hydroxid hlinitý - $Al(OH)_3$
Biela gélovitá, málo rozpustná látka
Amfotérne vlastnosti:
$\ce{2Al(OH)3 +3H2SO4 ->Al2(SO4)3 +6H2O}$
$\ce{Al(OH)3 +NaOH ->Na[Al(OH)4]}$ - tetrahydroxidohlinitan sodný
Hlinité halogenidy - $AlX_3$
- F - iónová zlúčenina, reáguje s fluroidmi kovov -> vznik komplexov (kryolit)
- Cl, Br, I - kovalentná väzba, tvoria diméry
AlCl3 - východisková látka pri výrobe mnohých zlúčenín Al
Využitie v organickej chémii
$AlK(SO_4)_2 \times 12H_2O$ = kamenec
V minulosti využitie v zdravotníctve ako holiaci kameň na sťahovanie krvácania
# Aluminotermia
Hútnický spôsob výroby kovov z ich oxidov pomocou Al
$\ce{Cr2O3 +2Al ->Al2O3 +2Cr} \quad \triangle H<0$
Al pôsobí ako redukovadlo -> veľká schopnosť odoberať kyslík od látok
Podobné reakcie s oxidmi krémiku, meďi, železa (termit), …
# Využitie
Alobal - v domácnosti a potravinárstve
Octan hlinitý - v zdravotníctve proti opuchom a zápalom