D-blok
- prechodné prvky (prvky B-skupín)
Všetky prvky sú kovy. Dobre vedú teplo a prúd. Sú ťažné, kujné, lesklé a majú vysokú teplotu topenia.
Spôsob získavania:
- $\ce{2ZnS + 3O2 -> 2ZnO + 2SO2}$ Praženie sulfidu
- $\ce{Zn^{II}O + C^0 -> Zn^0 + C^{II}O}$ Redukcia oxidu uhlíkom
$\ce{Zn^{II} + 2e- -> Zn^0}$ redukcia -> oxidovaldo
$\ce{C^0 - 2e- -> C^{II}}$ oxidácia -> redukovadlo
# I.B
Prvky skupiny medi
$\ce{Cu -> [_{18}Ar] 4s^1 3d^10}$
$\ce{Ag -> [_{36}Kr] 5s^1 4d^10}$
$\ce{Au -> [_{54}Xe] 6s^1 5d^10}$
$\ce{(n-1)d^10 ns^1}$
Kujné ťažké vodivé ušľachtilé kovy
# Meď
Najčastejšie $\ce{Cu^{+I},Cu^{+II}}$
Červenohnedý kov
Na vzduchu koroduje -> medenka - $\ce{Cu2CO3(OH)2}$
Biogénny prvok (tvorba pigmentov, kože, vlasov, hemoglobín)
Oba oxidy nerozpustné vo vode
$\ce{Cu2O}$ - červený
$\ce{CuO}$ - čierny
$\ce{Cu +HNO3 (\text{zried.}) -> Cu(NO3)2 + NO + H2O}$
$\ce{Cu +HNO3 (\text{konc.}) -> Cu(NO3)2 + NO2 + H2O}$
modrá skalica = $\ce{CuSO4.5H2O}$
Postreky v potravniárstve proti škodcom - fungicídy
# Striebro
$\ce{Ag2S}$ - argentit (minerál v prírode)
$\ce{AgX}$ - strieborné halogenidy
$Ag^+$ - dezinfekčné účinky
$Ag^0$ - antibakteriálne účinky
# Zlato
Mäkký žltý kov
Reaguje iba s lúčavkou kráľovskou - $\ce{3HCl:HNO3}$
$\ce{Au2O3}$
$\ce{AuX3}$
# II.B
Prvky skupiny zinku
$\ce{Zn -> [_{18}Ar] 4s^2 3d^10}$
$\ce{Cd -> [_{36}Kr] 5s^2 4d^10}$
$\ce{Hg -> [_{54}Xe] 6s^2 5d^10}$
$\ce{(n-1)d^10 ns^2}$
Typické oxidačné číslo je +II:
$\ce{Zn -2e- -> Zn^2+}$ -> $\ce{[_{18}Ar] 4s^0 3d^10}$
# Zinok
Striebrolesklý mäkký kov
Vyskytuje sa v sfalerite ZnS
Biogenný prvok:
- svaly, koža, kosti, nechty, vlasy
- nedostatok sa prejavuje stratou imunity a vypadavaním vlasov
Oxid zinočnatý - $ZnO$ - zinková beloba
Biela prášková látka s amfotérnymi vlastnosťami
Používa sa v kožnom lekárstve, je súčasťou krémov.
Hydroxid zinočnatý - $Zn(OH)_2$
Amfotérne vlastnosti
# Kadmium
Kademnaté zlúčeniny sú pre org. mimoriadne toxické.
Ukladá sa v pečeni a obličkách a atak znefunkční ich činnosť
Kadmiové tyče sa používajú v jadrových reaktoroch (spomaľovanie neutrónov)
# Ortuť
- Hydrargium
Oxidačné čísla: $\ce{Hg^2+ ; Hg+}$
# Využitie
Náplň do barometrov, teplometrov, sphygomomanometrov.
Ortuťové ventily, spínače, svietidlá.
# Zlúčeniny
Chlorid ortuťný - Kalomel - $\ce{HgCl2}$
Oxid ortuťnatý - $\ce{HgO}$
Sulfid ortuťnatý - Cinabarit/Rumelka - $\ce{HgS}$
# IV.B
# Titán
Vysoká teplota topenia a varu
Odolný voči korózii
V prírode len vo forme zlúčenín
Výroba: Krolov proces - $\ce{TiCl4 +2Mg -> Ti +2MgCl2}$
Zlúčeniny: $\ce{TiO2, TiCl4}$
Využitie:
- Kozmické technológie
- Letecký priemysel
- Chemický priemysel
- Súčasť lodí a ponoriek
- Šperky, náramkové hodinky
# VIII.B
Fe Co Ni - triáda železa
Ru Rh Pd - ľahké platinové kovy
Os Ir Pt - ťažké platinové kovy
# Nikel
Dobrý vodič tepla a elektriny, feromagnetický kov, mikroprvok v živých org.
Výroba: $\ce{NiO +C->Ni +CO}$
Hydroxid nikelnatý - $Ni(OH)_2$ - zelená zrazenina
Chlorid nikelnatý - $NiCl_2$ - svetlozelená zrazenina
Síran nikelnatý - $NiSO4$ - poniklovanie železných predmetov -> proti korózii
# Železo
# Výroba
1. Železná ruda:
- hematit (krveľ) - $Fe_2O_3$
- ocieľok (siderit) - $FeCO_3$
- magnetovec (magnetit) - $Fe_3O_4 = FeO * Fe_2O_3$
- pyrit - $FeS_2$
- limonit - $Fe_2O_3 * nH_2O$
2. koks - čierne uhlie - odoberá zo žel. rudy kyslík -> redukovadlo
3. vápenec
Vykonáva sa vo vysokej peci -> 30-50m vysoká a 7-10m široká
Horná časť sa nazýva sadrobná - striedavo sypeme rudu, koks a vápenec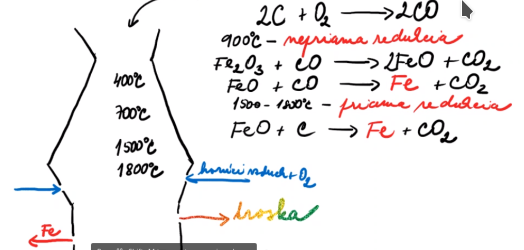
Železná ruda je znečistená zeminou = hlušina (SiO2)
Vypúšťame surové železo a trosku každé 2 hod. -> odpich
Surové železo - tuhé, krehké, nie je kujné
Obsahuje prímesi: P, Si, S, Mn
liatina - 2 až 4% C - výroba radiátorov
oceľ - < 1,7% C
Využitie ocele:
- výstuž do betónu
- tlakové zariadenia
- konštrukcie a opláštenia budov, strechy
- výroba čepelí
- oceľové nosníky
Korózia železa:
Vzdušná vlhkosť a kyslík vtvárajú hrdzu
$\quad \ce{4Fe + O2 + 2nH2O -> 2Fe2O3*nH2O}$
Ochrana železa pred koróziou -> galvanické pokovanie: poznikovanie/pochromovanie/poniklovanie
Alebo nátery