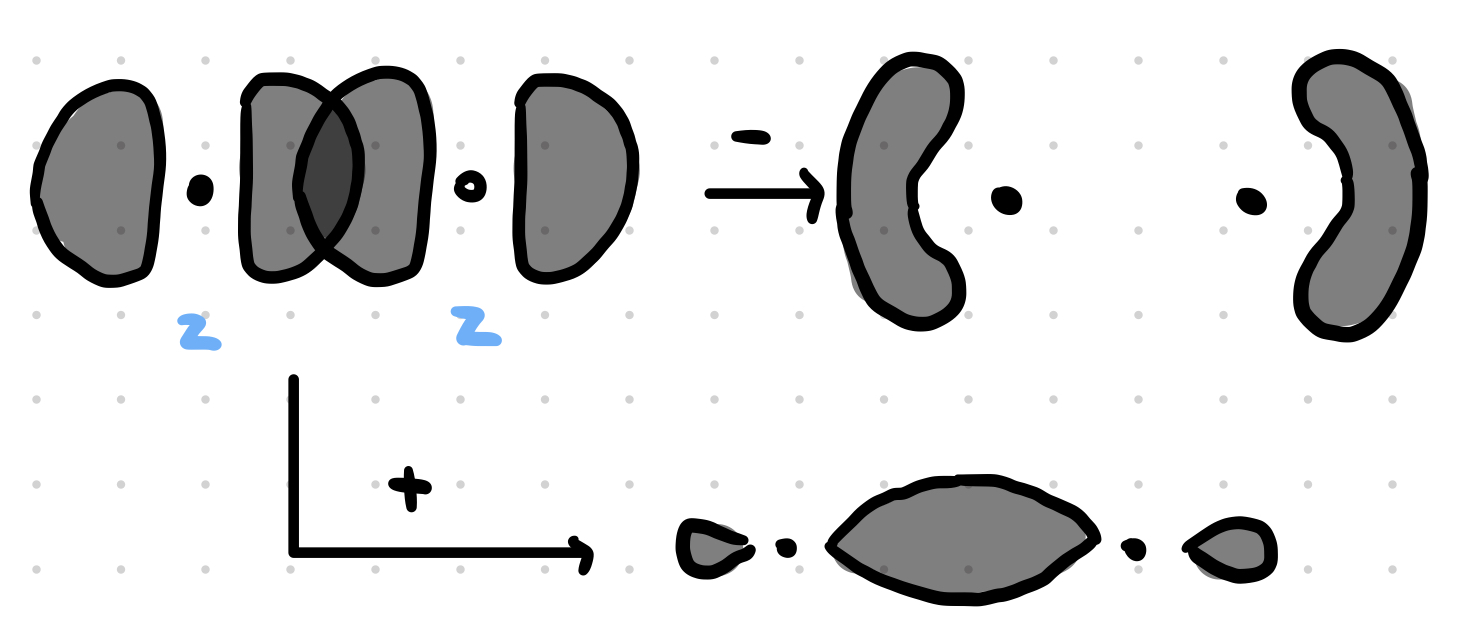Orbitály
-> Priestor okolo atómu s konkrétnou energiou, v ktorom sa môžu nachádzať maximálne 2 elektróny
– pravdepodobnostná distribúcia vlnovej funkcie spĺňajúca konkrétne kvantové čísla
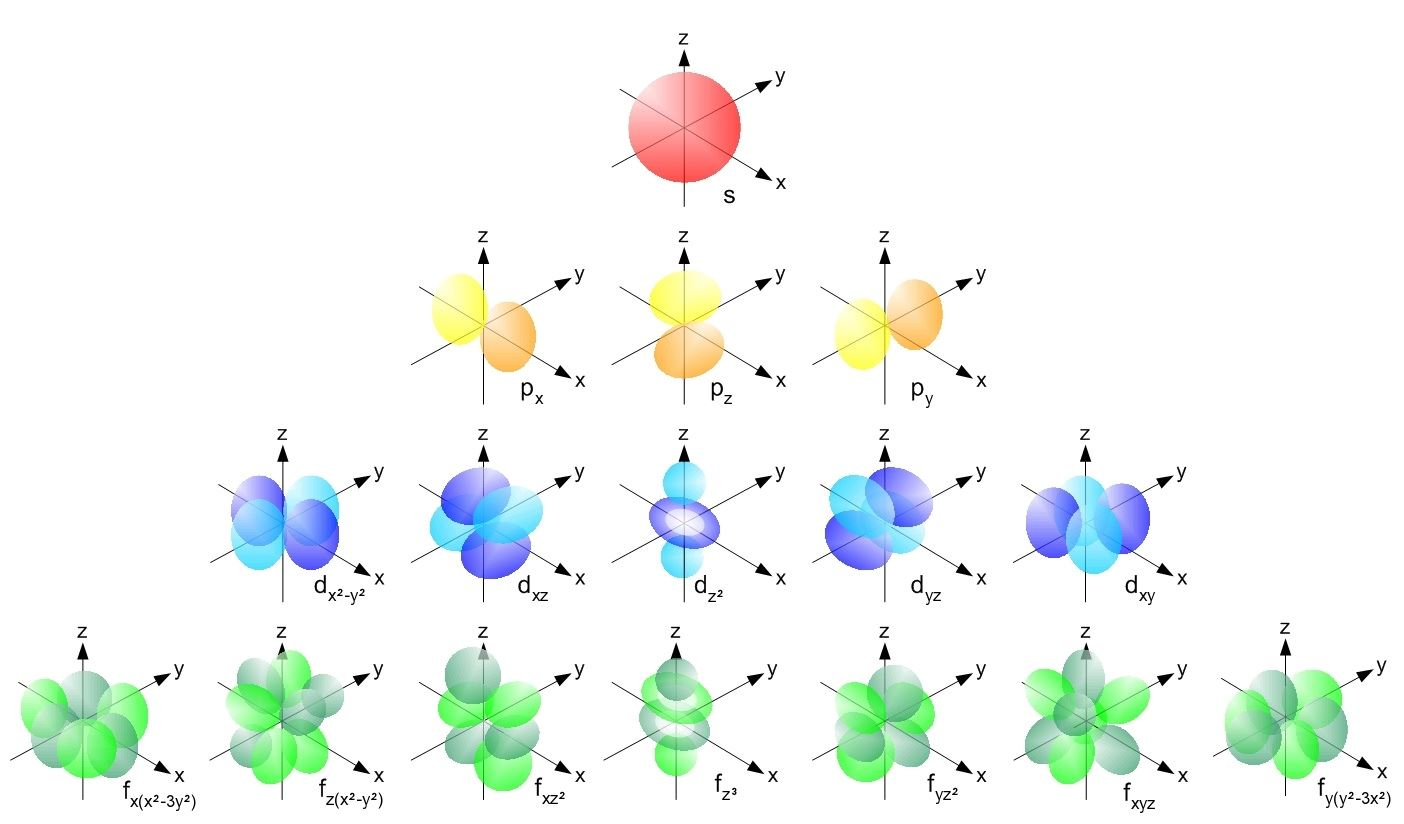
# Atómové orbitály
# Kvantové čísla
Koeficienty v riešení Schrodingerovej rovnice pre atóm vodíka
Existujú 4 :
- $n$ - energy -> $1 \to \infty$
- $l$ - angular momentum -> $0 \to (n-1) \iff s,p,d,f,g,...$
- $m_l$ - vector component of angular momentum -> $-l,...,0,...,l$ -> $2l + 1 =$ počet orbitálov daného typu
- $m_s$ - spinové číslo elektrónu
# Pravidlá orbitálov
- Pauliho vylučovací princíp -> v orbitále sa nachádzajú maximálne 2 elektróny
- Hundovo pravidlo -> najprv zapĺňame orbitály iba s jedným spinom, potom opačným
- Výstavbový princíp -> orbitály sa napĺňajú vzostupne podľa energie

# Molekulové orbitály
Sú spojením atómových orbitálov
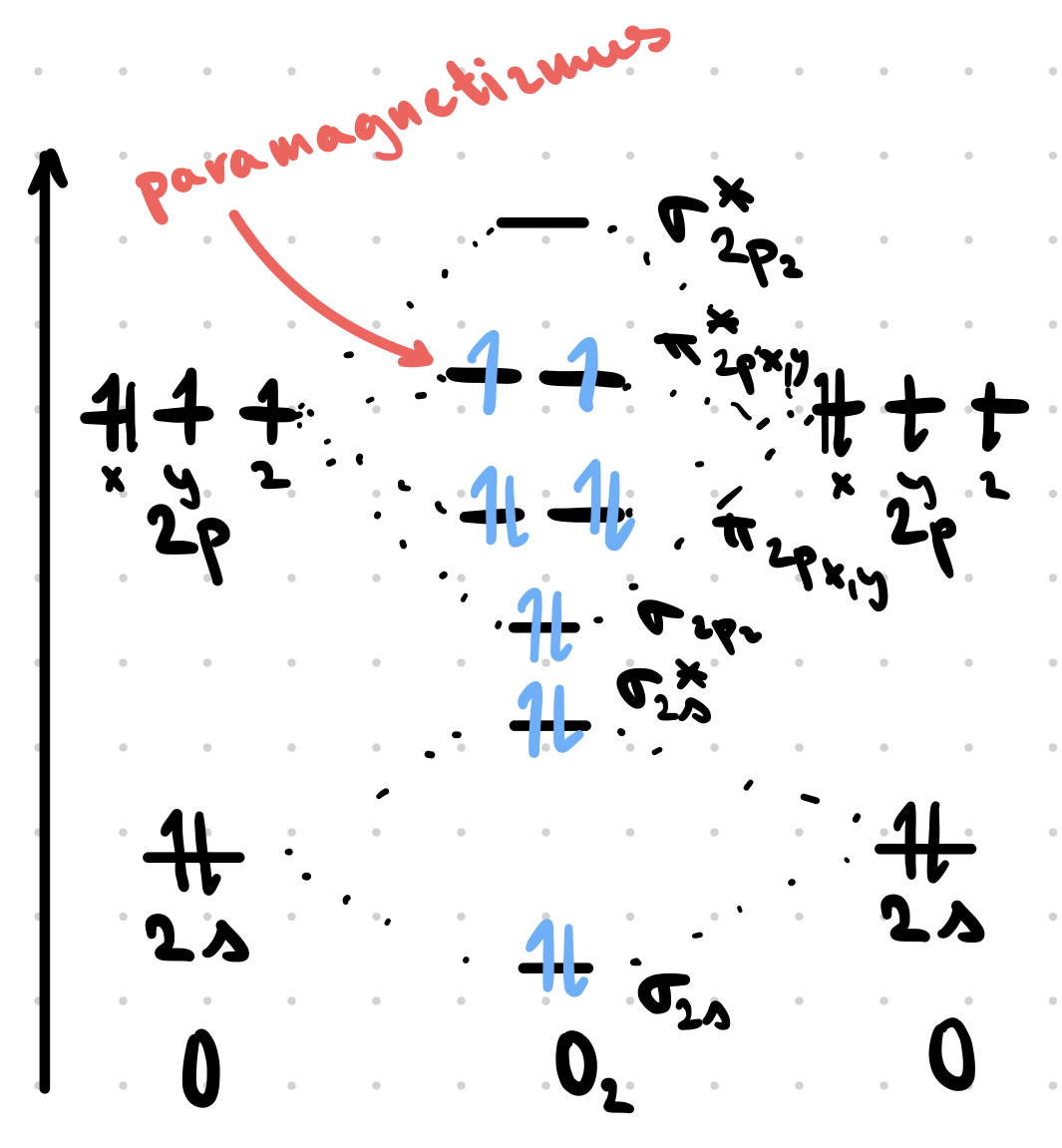
VSEPR nevie vysvetliť úplne všetky javy (paramagnetizmus $\ce{O2}$)
-» $\textbf{DOHODA}$ - os $z$ je spojnica medzi atómami
# Tvorba MO
-> MO ($\Phi$) sú lineárnou kombináciou AO ($\Psi$) rôznych atómov, pričom počet MO = počet AO
Väzbový poriadok:
$$N=1/2(\sum e^-_{vo}-\sum e^-_{pvo})$$
Multiplicita:
$$M=\text{počet nespárených elektrónov} + 1 = 2*| spin| + 1$$
Vodík: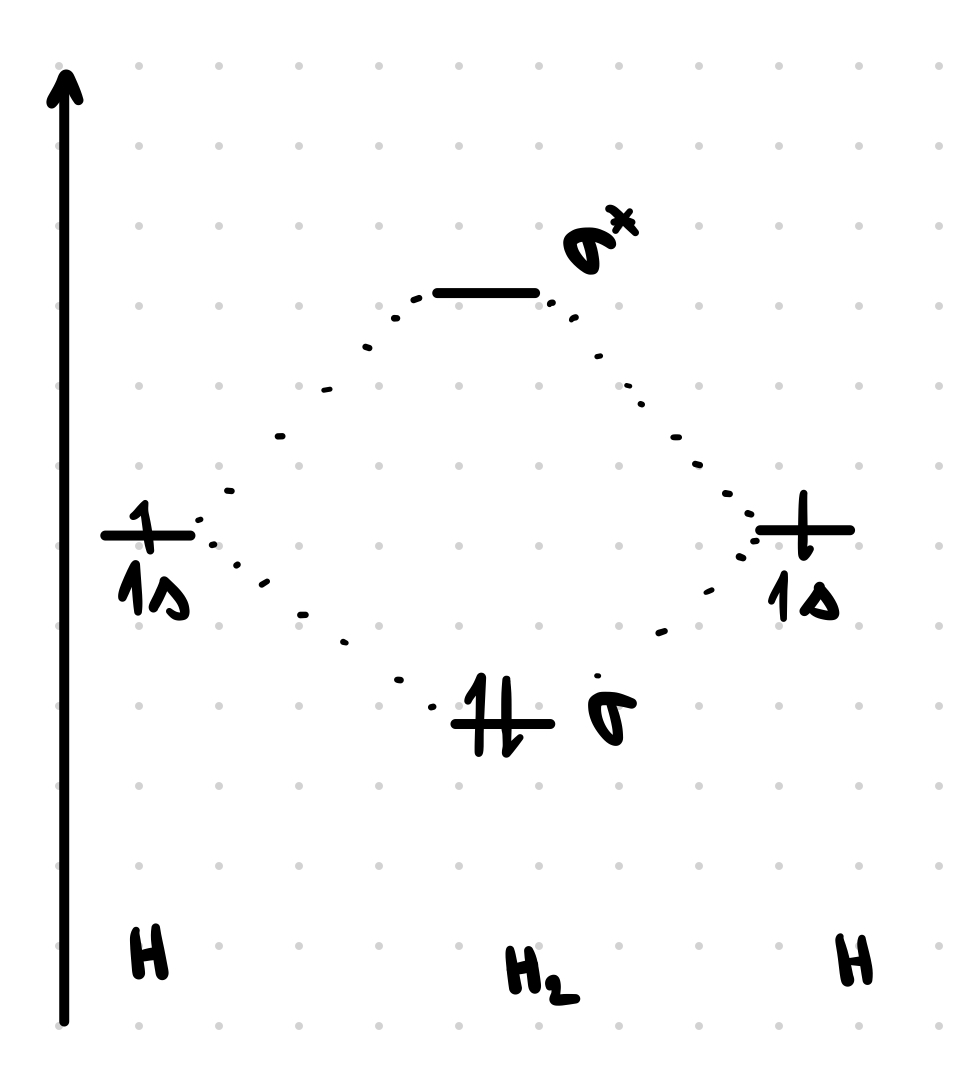
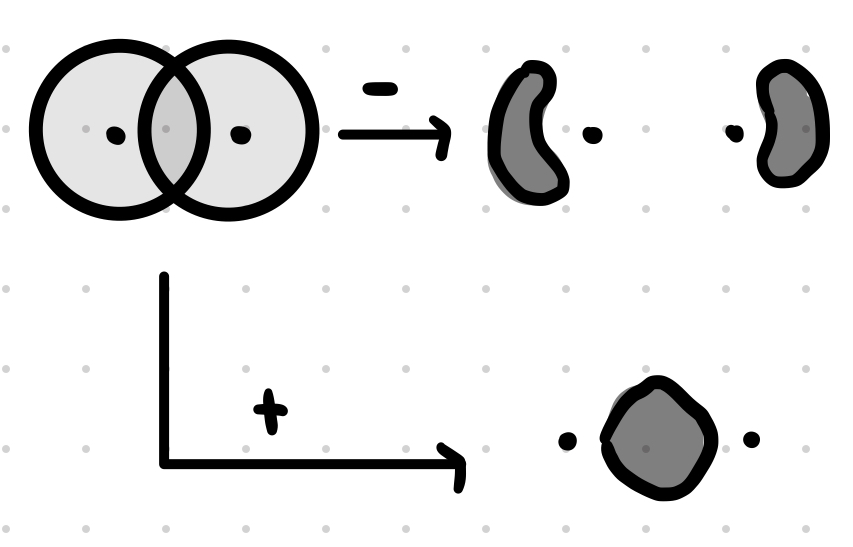
Kyslík: