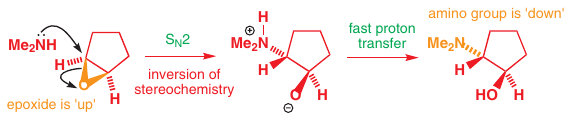
Nukleofilné substitúcie nasýtených uhlíkov
Existujú dva mechanizmy $S_n1, S_n2$
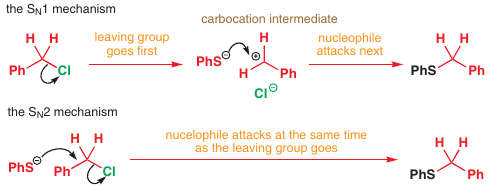
$S_N1$:
Reakcia je prvého poriadku
Rýchlosť určuje tvorba karbokatiónu, reakcia s nukleofilom je rýchla
Nezáleží na sile nukleofilu, či koncentrácii
$S_N2$:
Reakcia je druhého poriadku
Rýchlosť určuje sila nukleofilu, odstupujúca sila skupiny a sterická hinderance
Záleží na sile nukleofilu a konecntrácii
# Sn1 reakcia
$$r=k_1[\ce{R-X}]$$
Rýchlosť určujúci krok je tvorba karbokatiónu
Karbokatión reaguje s hocijakým nukleofilom (aj slabým)
Rýchlosť Sn1 záleží na:
- uhlíkovej kostre - substituovanosť elektrofilného centra (
delokalizácia) - odstupujúcej skupine
# Stabilizácia karbokatiónu
Ak je karbokatión stabilizovaný, tak je rýchlosť tvorby vyššia
PI systémy:
- dvojité väzby

- aromatické jadrá
- VEP - $\ce{N, O, S}$
Substituenty (sigma väzby):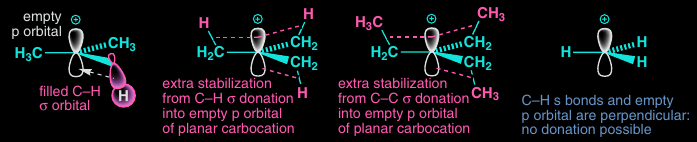
# Sn2 reakcia
$$r = k_2[\ce{R-X}][\ce{Nu^{[-]}}]$$
Rýchlosť Sn2 záleží na:
- nukleofile
- uhlíkovej kostre - substituovanosť elektrofilného centra (
steric hinderance) - odstupujúcej skupine
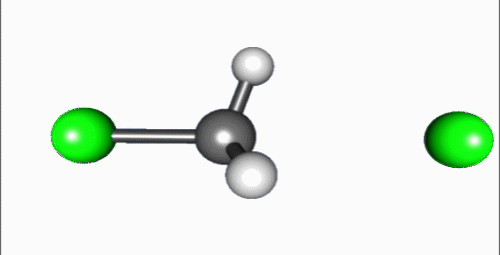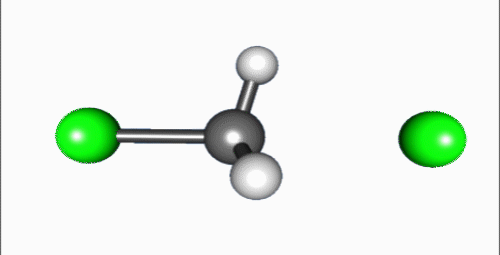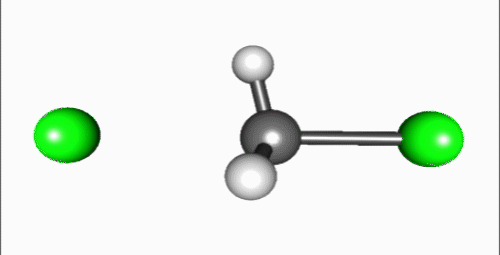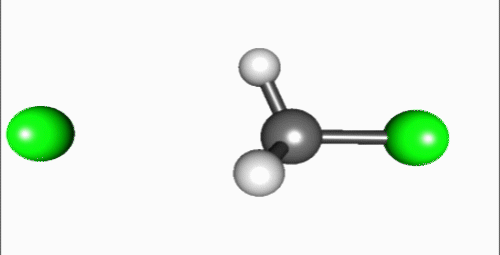
Reakcia invertuje stereocentrum
# Nukleofily
Silu nukleofilu vieme odvodiť od pKa konjugovanej kyseliny: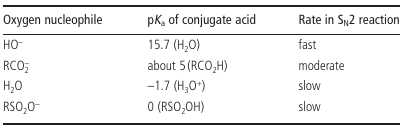
Vysoké pKa <=> zlá kyselina => nukleofil nestabilný => REAKTÍVNY
Nízke pKa <=> dobrá kyselina => nukleofil stabilný => NEREAKTÍVNY
# Stabilizácia
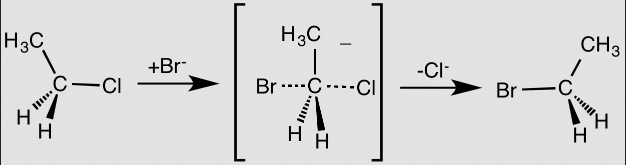
Medzistav má najvyššiu energiu, dokáže byť stabilizovaný P orbitálmi: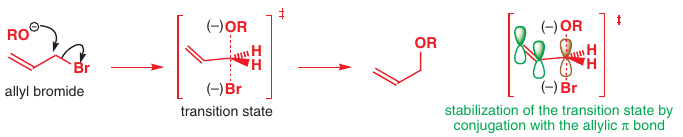
# Ako určiť mechanizmus
Oba typy väčšinou prebiehajú súčasne, pričom…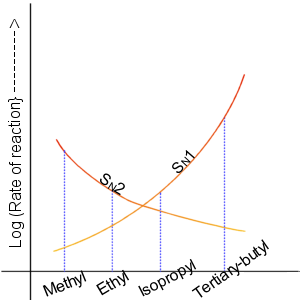
…najdôležitejší bod je štuktúra uhlíkovej kostry: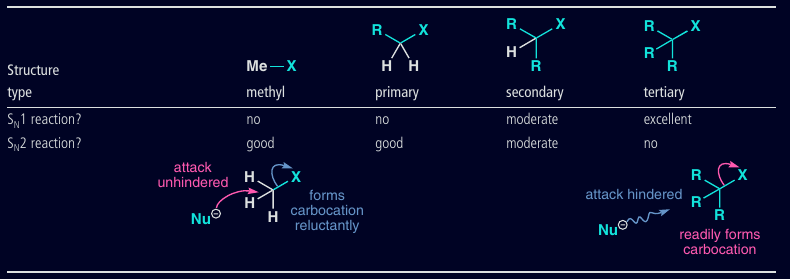
Sn1 prebieha ak je karbokatión dobre stabilizovaný: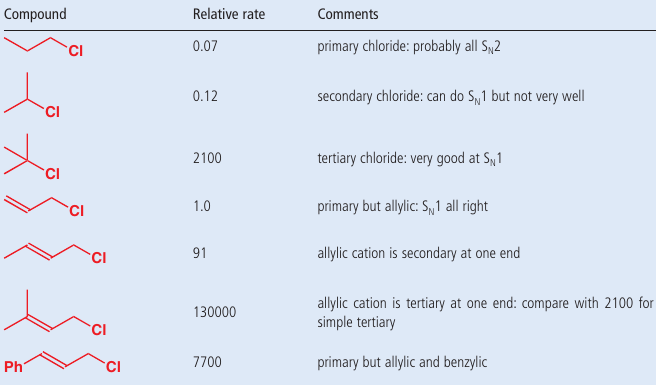
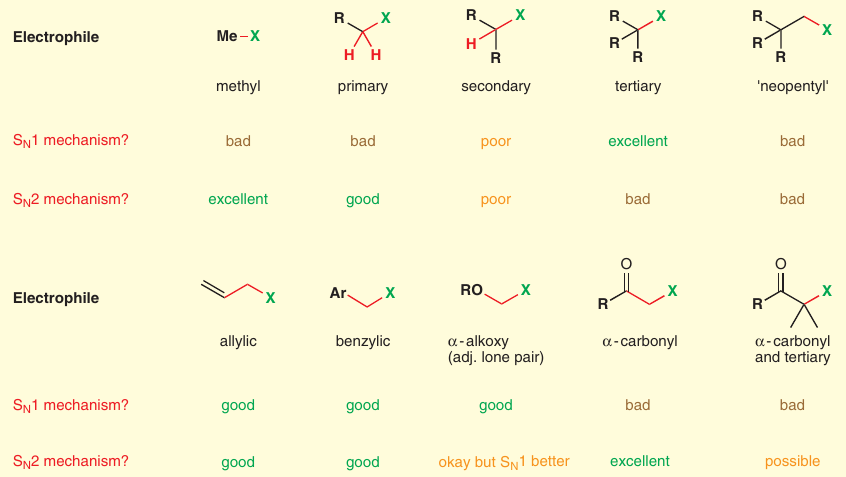
# Odstupujúce skupiny
Sú dôležité v oboch reakciach, pretože sú v rate-limiting step
Schopnosť odstúpenia sa odvíja od sily väzby a $\textbf{pKa}$ konjug. kys. (stability aniónu)
# Odstúpenie OH
$\ce{(OH)-}$ nikdy nie je odstupujúca skupina
Protonácia:
Musíme OH naprotonovať aby odstpujúca skupina bola voda
Tosylácia, mesylácia: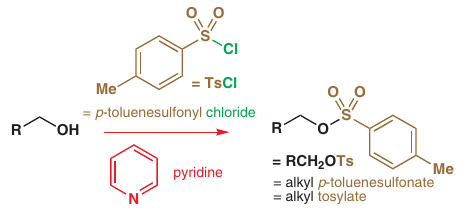
Mitsunobu reakcia: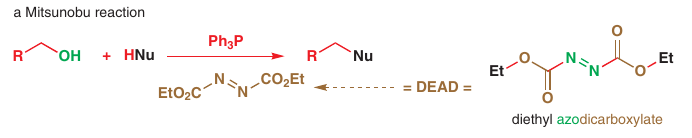
# Rôzne elektrofily
Étery: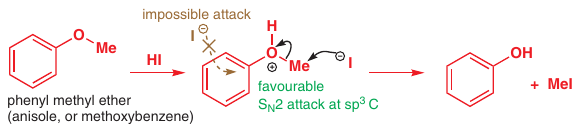
Epoxidy: