Karbonylové zlúčeniny
-> $\ce{R-COH (aldehydy), R-CO-R (ketóny)}$
Keto-enol:
Vodíkové väzby pomáhaju stabilite enol formy pri 1,3-keto (enol) derivátoch
Kyseliny dokážu katalyzovať premenu ketónu na enol -> zrýchlenie reakcie s enolom
# Nukleofilné adície
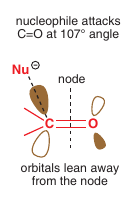
Nukleofil sa naväzuje na C atóm cez $\pi^*$ orbitál
Prečo?:
$\pi$ väzba karbonylu je polarizovaná -> $\pi^b$ má O charakter a $\pi^*$ (LUMO) má C charakter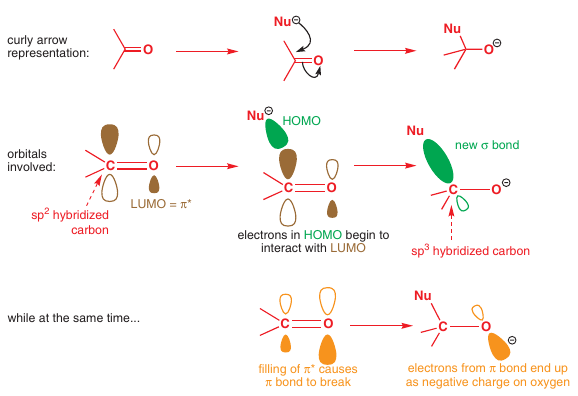
# Efekty
Sterické efekty:
Adície sú výhodnejšie pre aldehydy než ketóny (menej substituentov je lepšie)
Vďaka tomu sú aldehydy najreaktívnejšie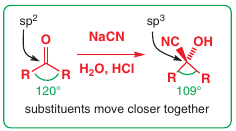
# Reakcie
Kyanidy: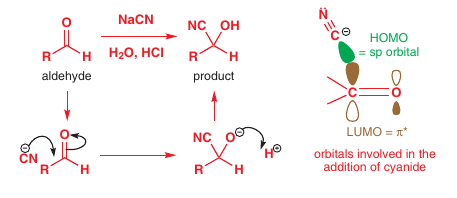
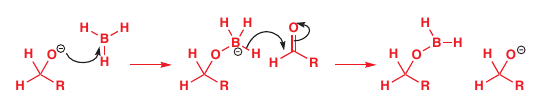
Hydrogenácia:
Tzv. hydride transfer
Pomocou $\ce{NaBH4, LiAlH4, ...}$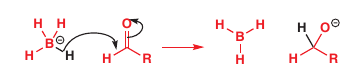
# Adície kyslíkatých derivátov
Reakcia s alkoholmi: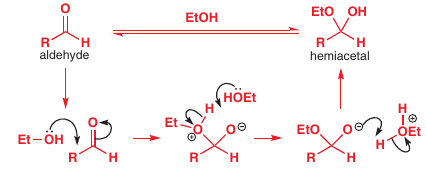
Cyklizácia pri hydroxy-aldehydoch: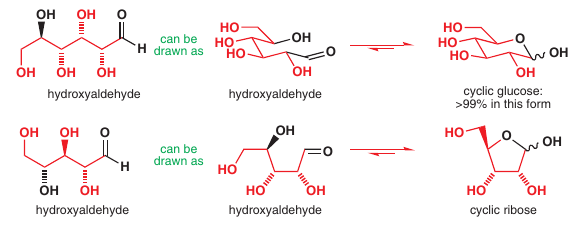
Cyklizácia pri hydroxy-ketónoch je možná pri špeciálnych podmienkach: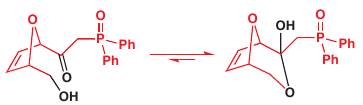
Acidobazická katalýza: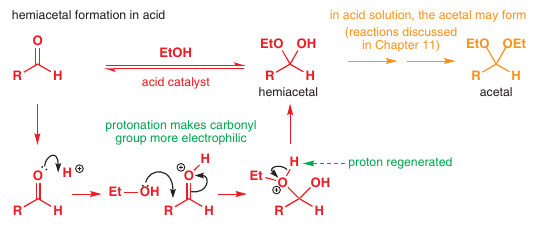
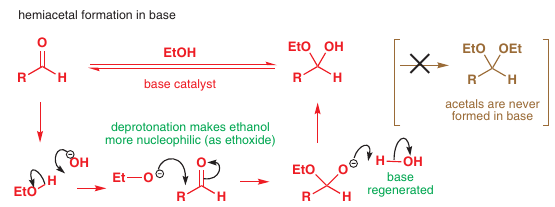
# Alkylácie
Prebiehajú vďaka polarizácii $\sigma$ väzby medzi kovom a C
Sú veľmi dôležité -> tvorí sa C-C väzba
Organolítne: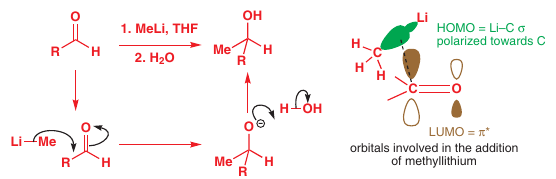
Grignardové: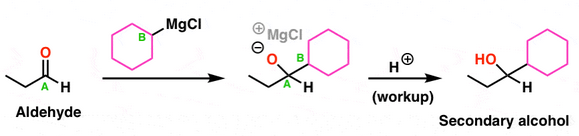
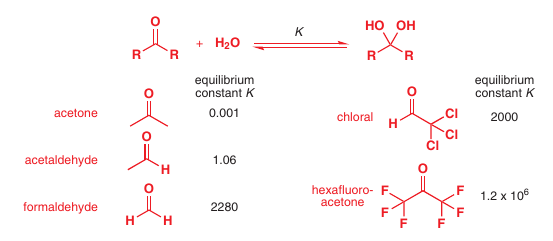
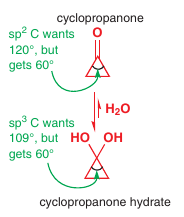
# Hydratácie (nekatalizované)
Voda je aj nukleofil a tak vie reagovať s karbonylmi (hlavne aldehydmi kvôli sterickým efektom)
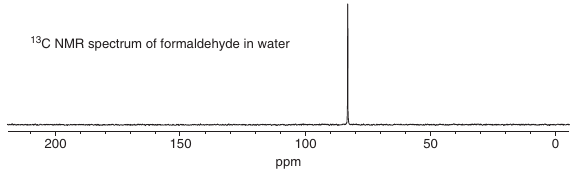
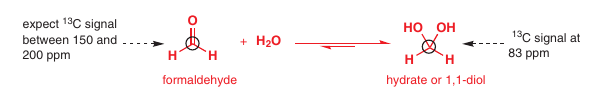
# Adícia síričitanu

Nie je potreba kyslej katalýzy pri adícii kyanidu -> bezpečnejšie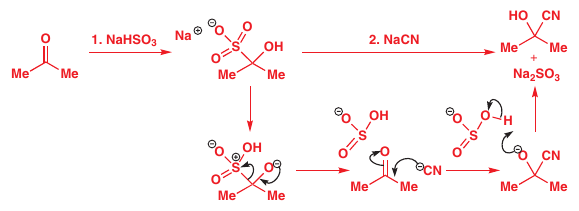
# Hydrolýza nitrilov
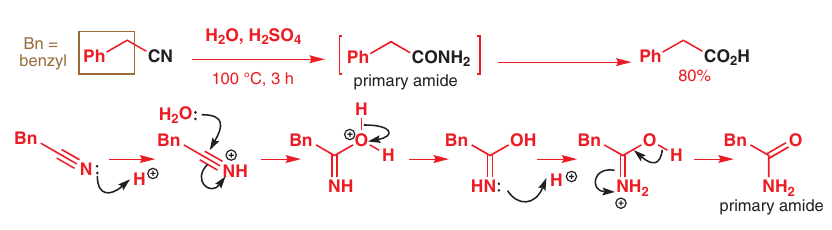
# Nukleofilné substitúcie
Sú kombináciou adície (na karbonyl) a elminácie (z nestabilného intermediátu)
Produkt
nukleofilnej adície na karbonyl nie je vždy stabilný: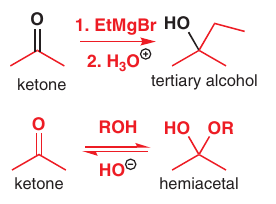
Niekedy sa vylúči aj originálna karbonylová skupina
Prebieha iba ak niektorý substituent je
odstupujúci -> dokáže odobrať od kyslíka intermediátu (alkoxidu) záporný náboj
Reakcia prebehne iba ak: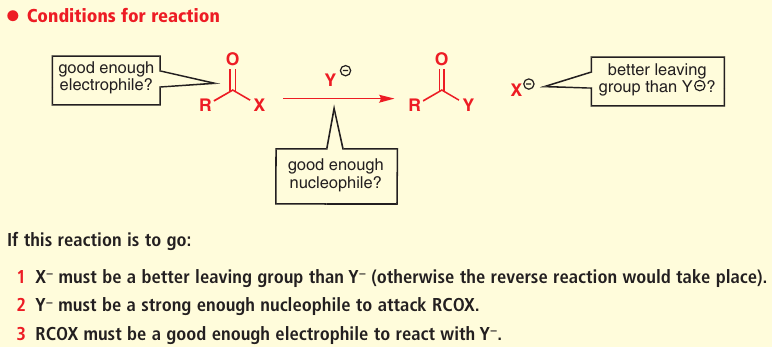
# Deriváty karboxylových kyselín
Čím delokalizovanejší je
alylový systém, tým je menej reaktívny: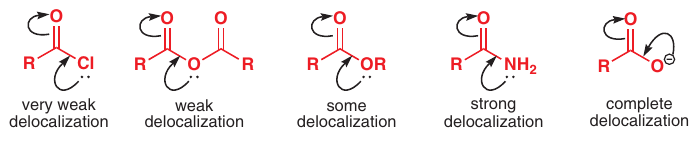
# Tvorba esterov z acyl chloridov a anhydridov
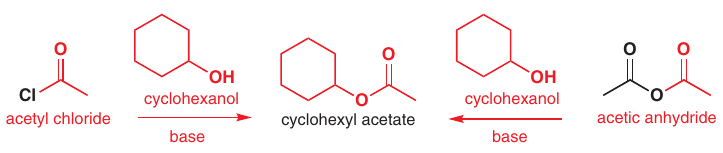
Mechanizmus: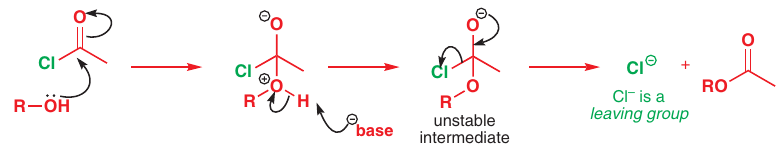
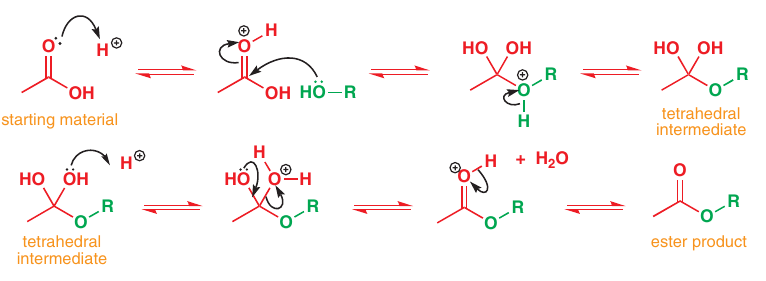
# Esterifikácia, transesterifikácia a hydrolýza KK kyslou katalýzou
Kyslá katalýza robí karbonyl elektrofilnejším (protonáciou) a robí z vody lepšiu odstupujúcu skupinu
Esterifikácia
Táto reakcia je ale reverzibilná, rovnováhu chceme posunúť čo najviac doprava:
- pracovať v roztoku alkoholu, nie vody, alebo použiť nadbytok alkoholu
- použiť
dehydratujúce činidlo - destilovať vodu počas reakcie
Hydrolýza
Rovnako ako predošlá reakcia je reverzibilná, vieme ju podporiť nadbytkom vody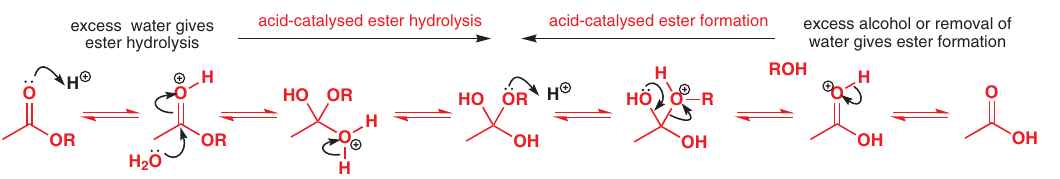
Transesterifikácia:
Zámena R skupiny na kyslíku esteru, stále je to rovnovážna reakcia, ale vieme ju posunúť napr. destiláciou konkrétnej nechcenej skupiny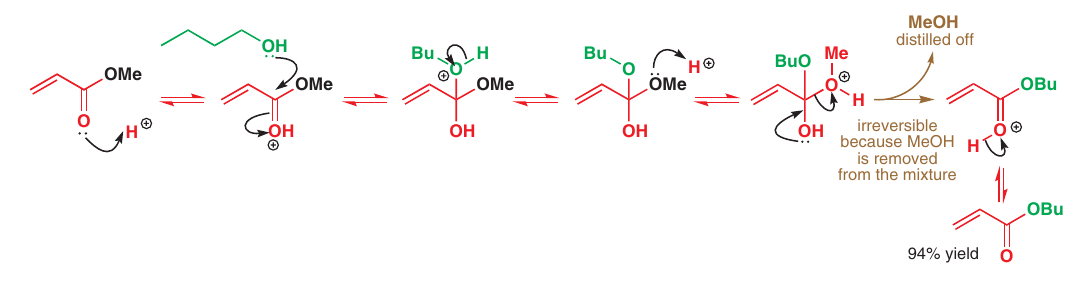
# Ireverzibilná hydrolýza esterov bazickou katalýzou
Pri použití zásady ako katalyzátora tvorí KK soľ -> oddeliteľná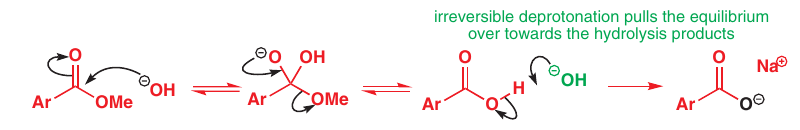
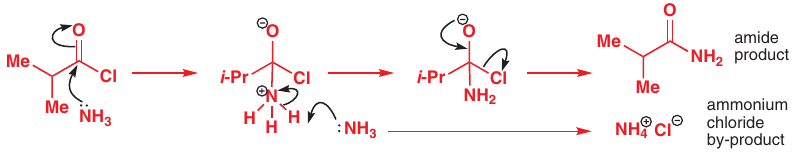
# Tvorba amidov pomocou amínov
# Hydrolýza amidov
Kyslá katalýza:
Protonácia nastáva na karbonyle nie dusíku (kvôli delokalizácii)Amín je substituovaný vodou -> naprotonovaný amín $\ce{NR3H+}$ je kyslejší než $\ce{H3O+}$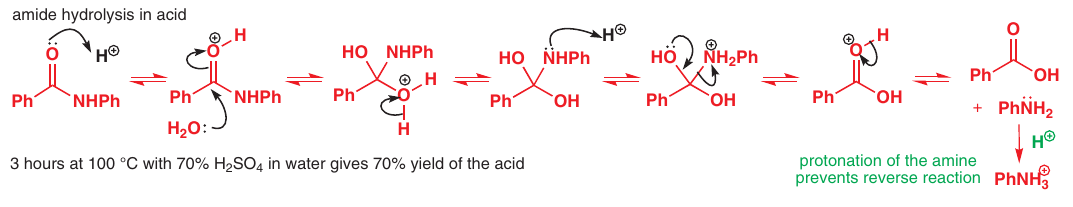
Bazická katalýza:
Reakcia prebieha iba vďaka nereaktivita karboxylátu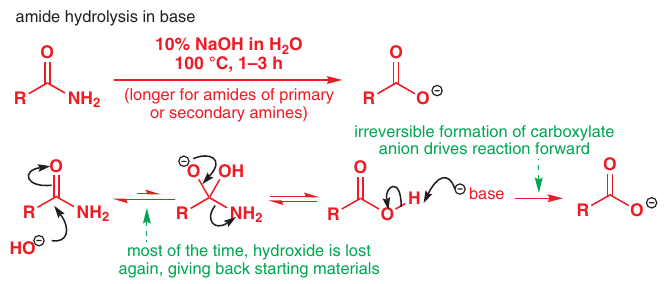
# Syntéza achirálnych terciárnych alkoholov z esterov
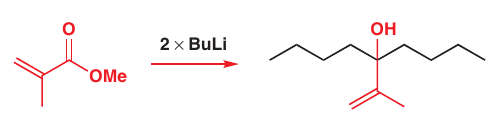
# Substitúcie so stratou karbonylu
# Formácia acetálov
Acetály sa formujú z aldehydov alebo ketónov (iba cyklické) pomocou alkoholu a kyseliny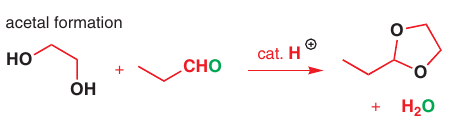
Je to reberzibilná reakcia, treba sa zbavovať vody
Pri reaktívnejších aldehydoch stačí nadbytok aldehydu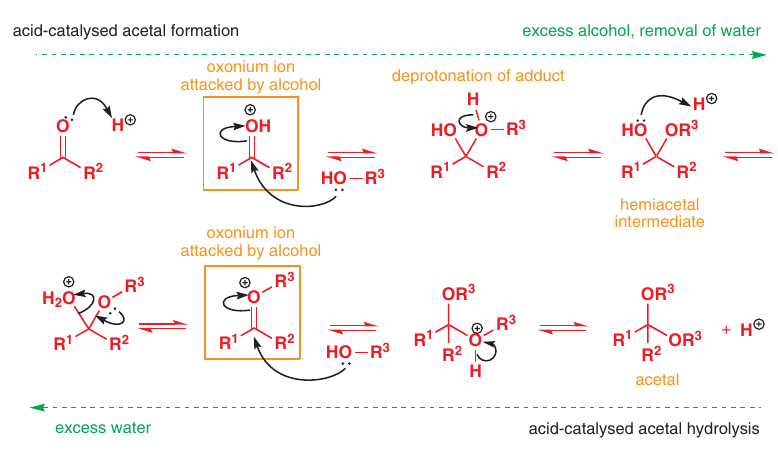
Hydrolýza acetálov:
Prebieha iba v prítomnosti kyseliny a vody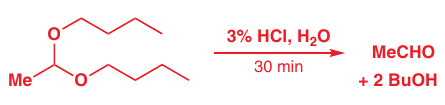
Cyklické acetály:
Reakcie prebiehajú aj na ketónoch -> ketály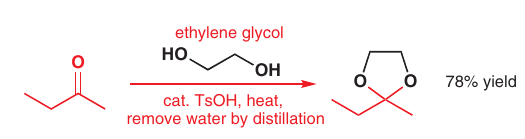
Dokážeme nimi modifikovať reaktivitu ketónu: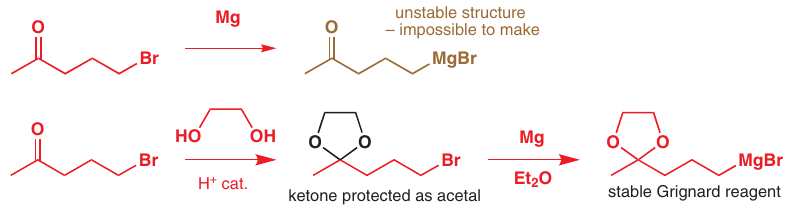
# Formácia imínov
Reakcia karbonylu a primárneho amínu za vzniku imínu (dusíkový ekvivalent karbonylu)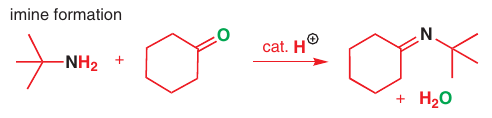
pH musí byť tiež kontrolované -> amín je protonovaný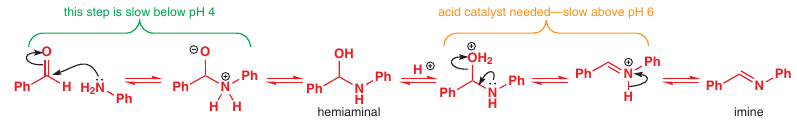
Stabilné imíny:
Rovnako ako actály sú nestabilné (hydrolyzujú) voči karbonylu a a voda musí byť odoberaná
Sú izolovateľné iba ak má N alebo O naviazané aromatické jadro, alebo musí byť na N naviazaný elektronegatívnejší atóm -> delokalizuje dvojitú väzbu a zvyšuje LUMO
# Formácia énamínov
Reakcia karbonylu a sekundárneho amínu za vzniku enamínu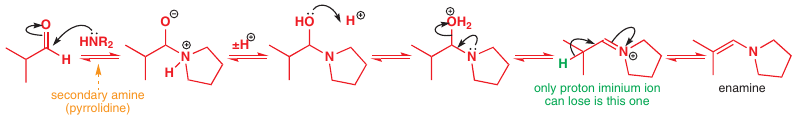
Vzťah medzi imínom a enamínom je rovnaký ako pri ketóne a enole
# Syntéza amínov cez enamíny
Tzv. reduktívna aminácia -> ketón reáguje s amínom/amoniakom a redukovadlom => N-amín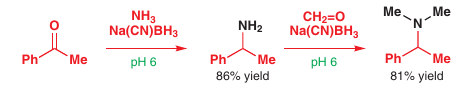
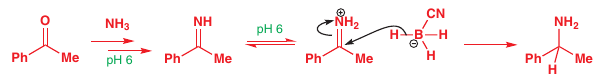
# Redukcia amidov na amíny
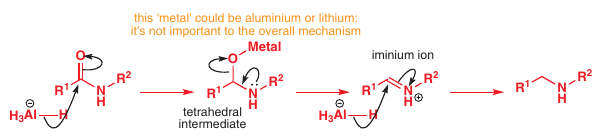
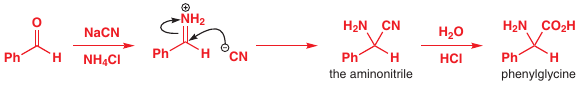
# Streckerova syntéza aminokyselín
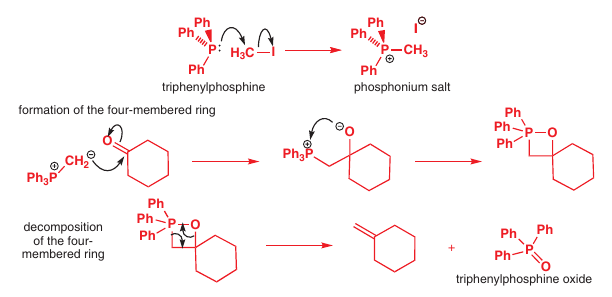
# Wittigova reakcia (C=O -> C=C)