Delokalizácia a konjugácia
-> Interakcia viac ako 2och $p$ orbitálov na susedných atómoch, tvoria sa stabilnejšie MO
Elektróny nie su lokalizované v $\pi$ väzbách, ale distribuované v konjugovanom systéme $p$ orbitálov
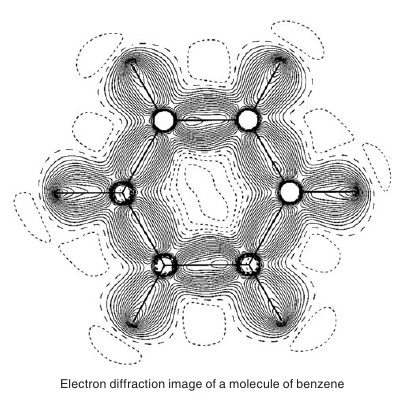
Konjugované systémy musia byť rovinné a $p$ orbitály oddelené práve jednou $\sigma$ väzbou: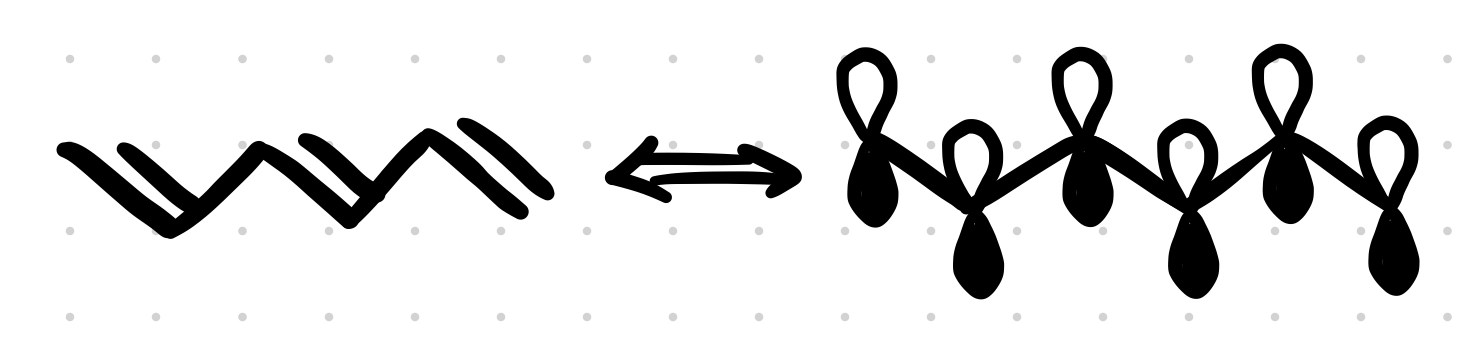
Pokiaľ nie je veľký rozdiel vo veľkosti, môžu byť konjugované aj s inými atómami: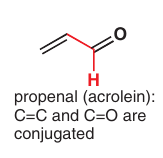
Kumulované $p$ orbitály nekonjugujú: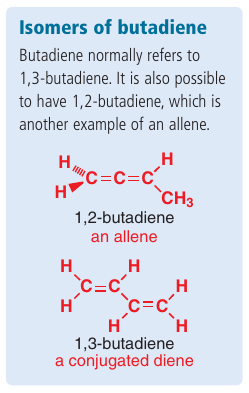
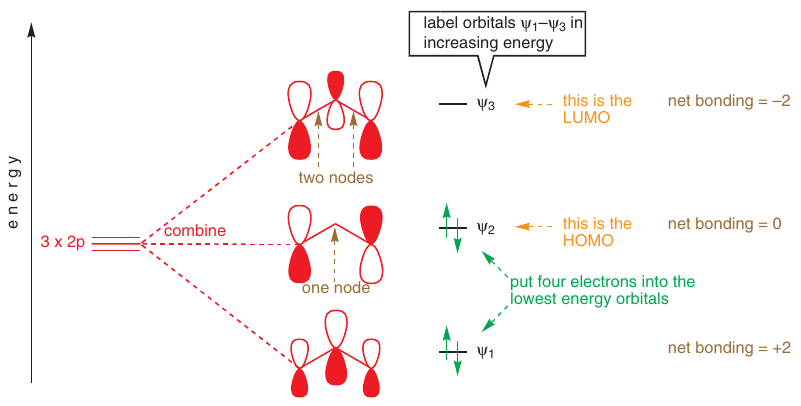
# Molekulové orbitály
-> Sú najlepším vysvetlením konjugácie
Butadién: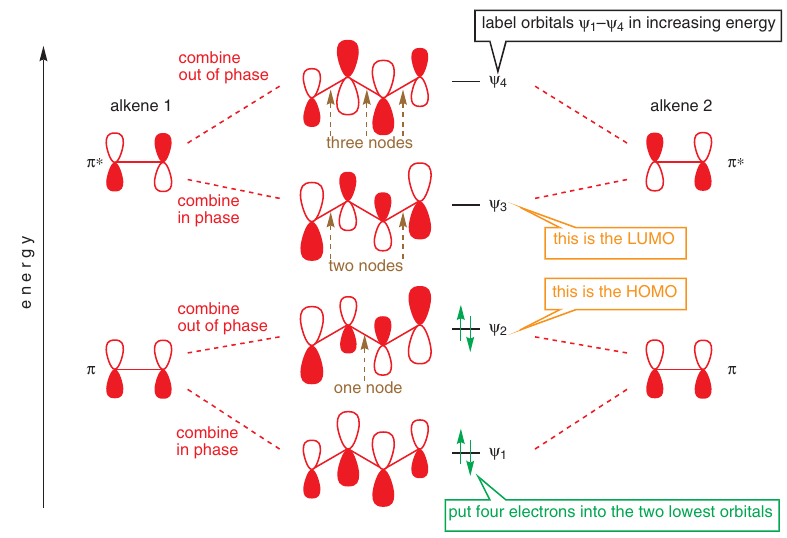
# Vlastnosti látok
Dĺžka väzieb:
Energia
otáčania väzby: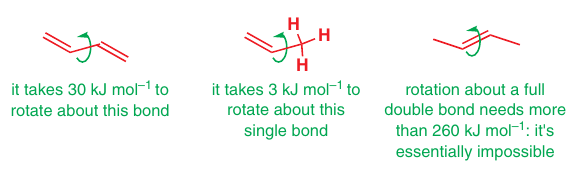
Absorbcia svetla: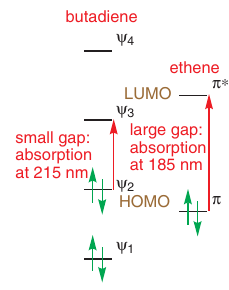
# Alylový systém
Pri odštiepení $\ce{H+}$ alebo $\ce{Br-}$ od allylu vzniká konjugovaný systém 3och $p$ orbitálov
-> vlastnosti dedukované z MO sú všeobecné pre všetky konjugované systémy s 3oma $p$ orbitálmi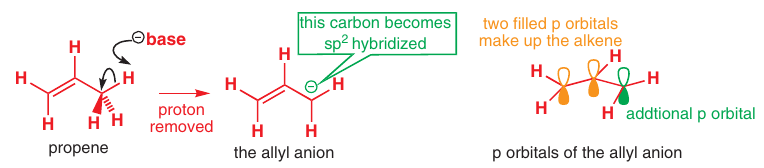
# Anión
Vďaka MO vieme, že elektróny sú koncentrované v koncových atómoch: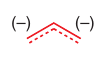
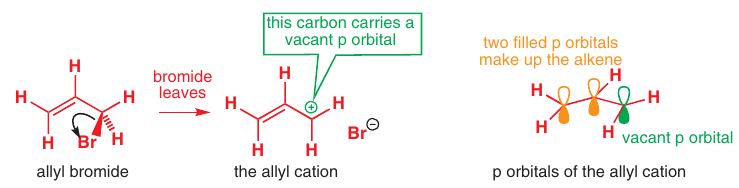
# Katión
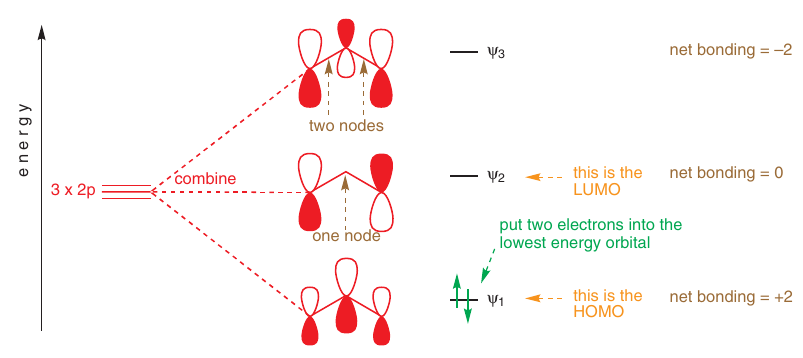
Rovnaké orbitály ako v anióne, ale koncové atómy strácajú elektróny:
# Ekvivalenty
Rovnaké systémy tvoria aj iné skupiny:
Karboxyláty:
Nitro-skupiny: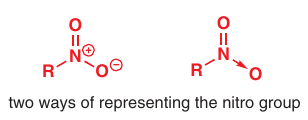
Amidy:
C-N väzba je silnejšia, kratšia, energeticky stabilnejšia, tažšie otáčaná (88kJ/mol), ale aj polarizovaná
Atóm dusíka má čiastočný kladný náboj kvôli delokalizácii a je v $sp^2$ hybridizácii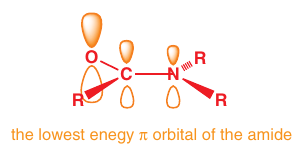
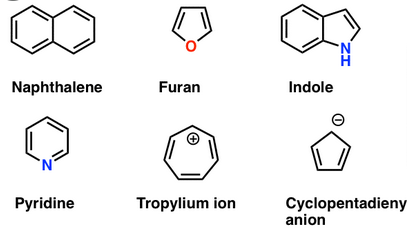
# Aromaticita
-> Ploché cyklické zlúčeniny, v ktorých každý atóm cyklu má konjugovaný $p$ orbitál a [4n+2] $\pi$ elektrónov
4 podmienky pre molekulu:
- Je cyklická
- Každý atóm má konjugovaný $p$ orbitál -> $sp^2$
- Má $4n+2 \ \pi$ elektrónov (Huckel) -> 2, 6, 10, 13,…
- Je rovinná