Molekuly
# Chemická väzba
See also: Orbitály
-> elektromagnetická interakcia medzi atómami alebo jónmi, ktorá znižuje potenciálnu energiu a tvorí väčšie častice
$s-\sigma \ > \ p-\pi \ > \ d-\delta$
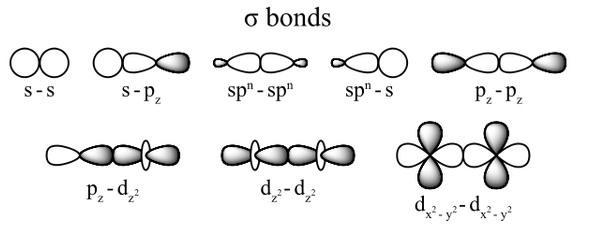
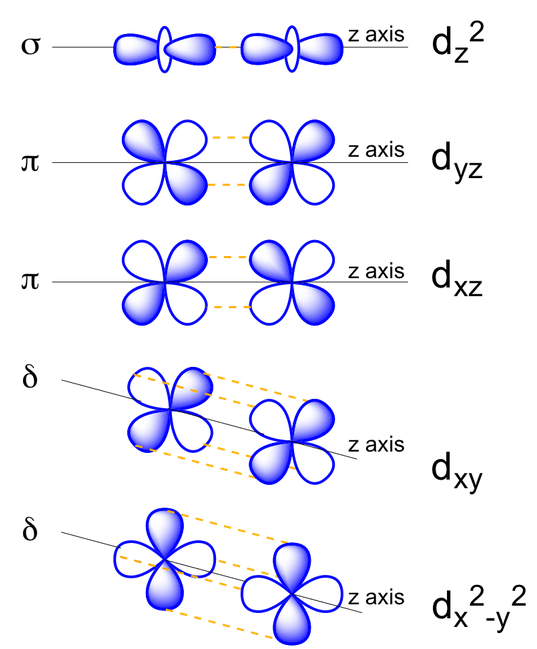
# Elektronegativita
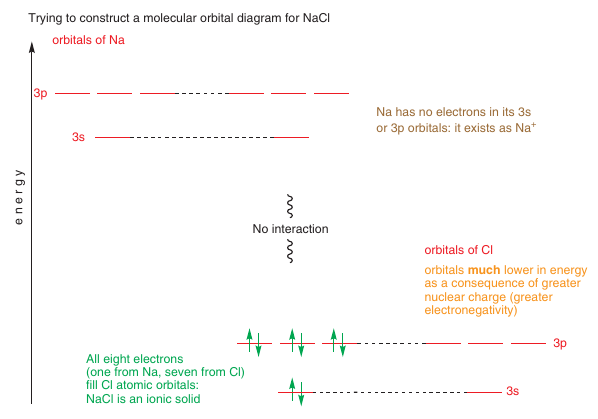
Je to výsledok tvorby
MO medzi jadrami -> látky s nižšími orbitálmi sú elektronegatívnejšie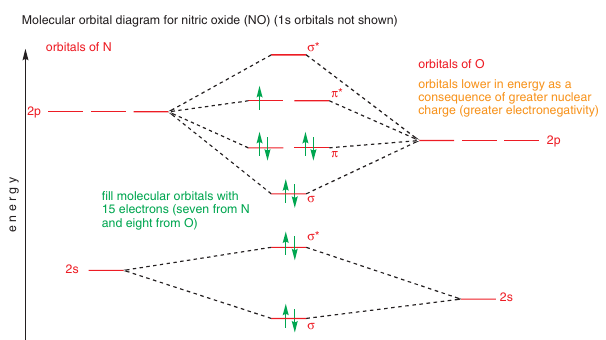
# Štruktúrny vzorec
Určenie väzieb:
- Určenie usporiadania atómov
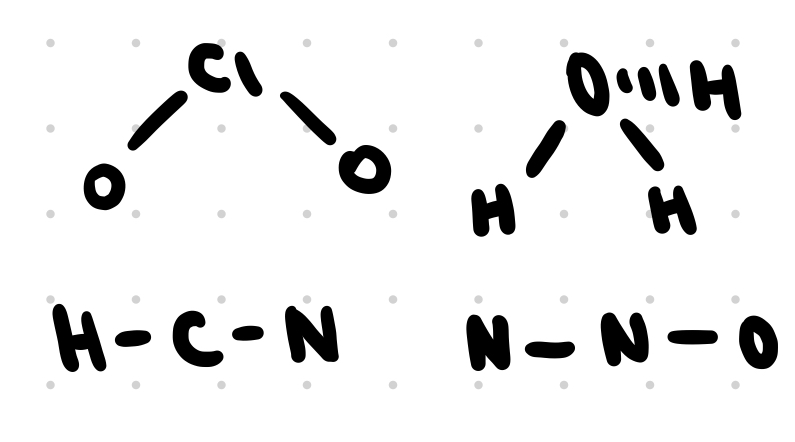
- Určenie počtu zvyšných elektrónov
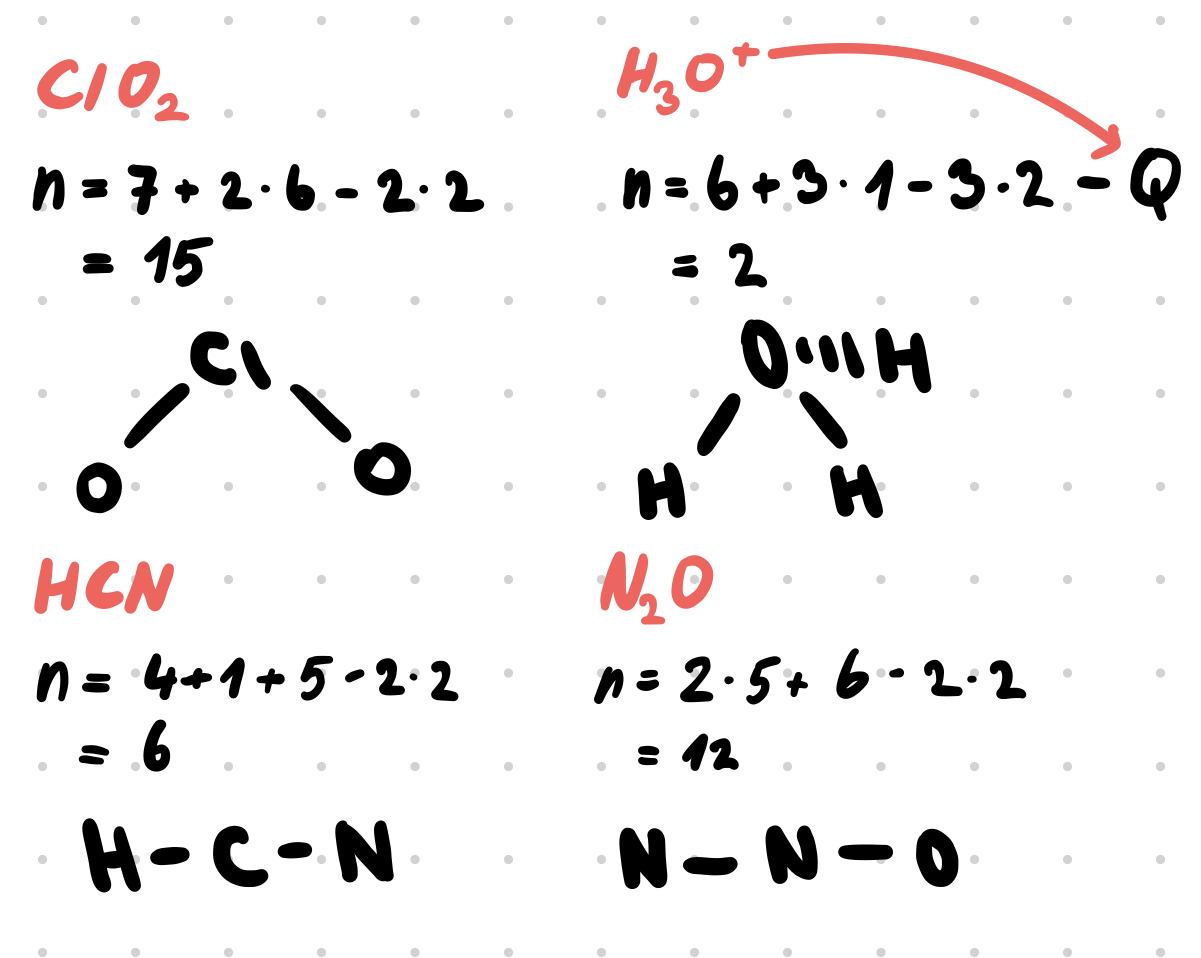
- Umiestnenie EP do orbitálov a určenie nábojov

- Určenie tvaru
Určenie počtu sigma väzieb a NeVEP 1 stredového atómu ($\pi$ väčšinou nemajú vplyv)
Odpudzovanie $\text{nvep-nvep } > \text{ nvep-}\sigma \ > \sigma-\sigma$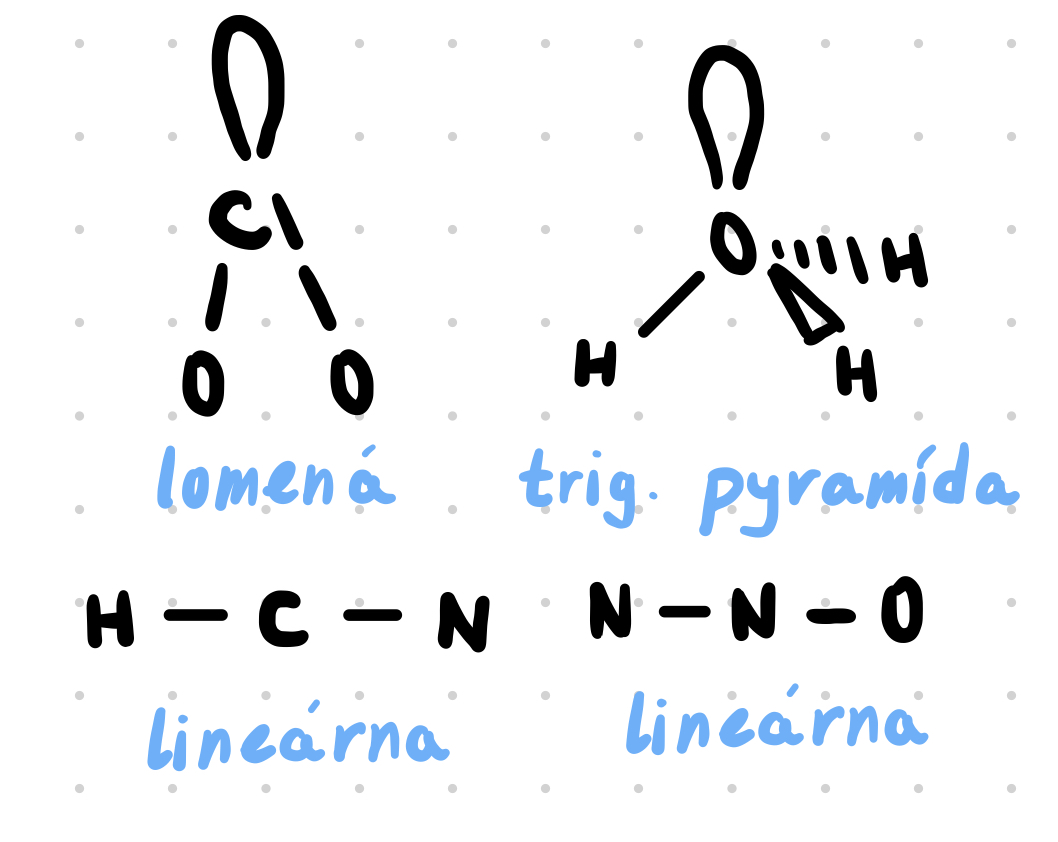
# Tvary molekúl
Podľa princípu VSEPR -> valence shell electron pair repulsion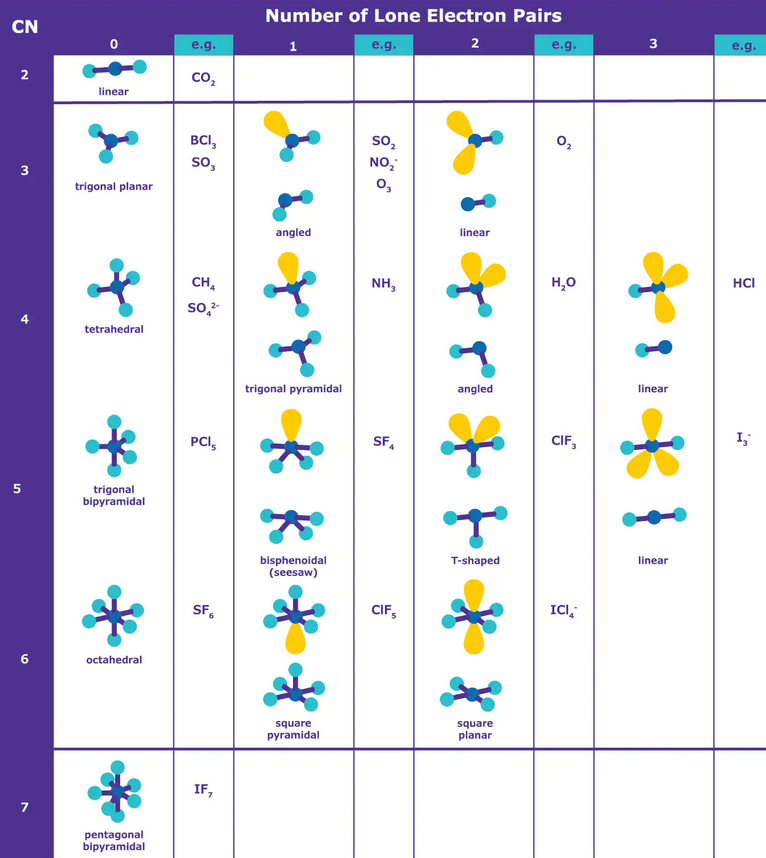
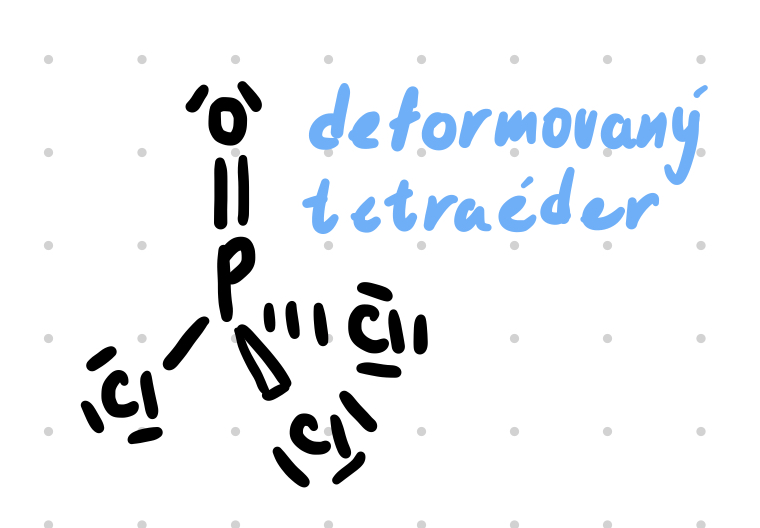
Tvar komplexov:
Určuje sa podľa chromoforu (abstraktný štruktúrny vzorec)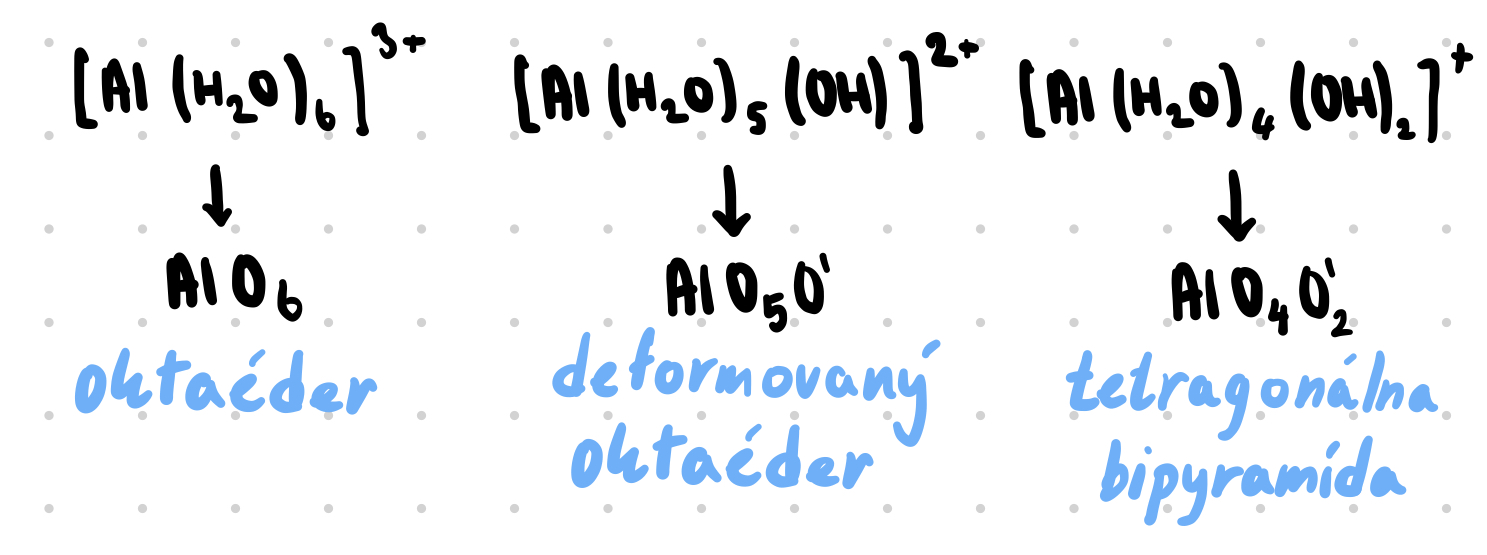
# Polarita molekúl
Určuje dipólový moment:
$$\vec\mu = \sum q * \vec l_i * e$$
Kde $q$ je posunutie náboja vrámci väzieb bez jednotiek (v elektrónoch), $\vec{l_i}$ je vektor do centra jadra naviazaného atómu v metroch a $e$ je elementárny náboj v coulumboch
Aj voľné elektrónové páry majú vplyv na dipólový moment: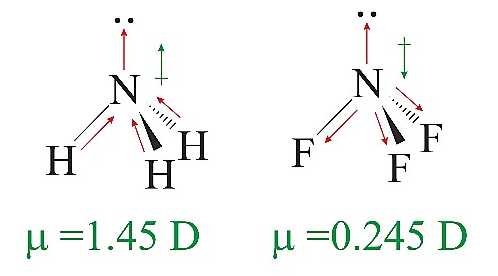
# Vibračné módy
Pre lineárne molekuly: $3n-5$
Pre nelineárne molekuly: $3n-6$ ; n = počet atómov
neväzbový elektrónový pár ↩︎