Intermolekulárne sily
Sily, ktoré vedú interakciu medzi molekulami, voľnými atómami či jónmi
Oproti intramolekulárnym silám sú slabé
Všetky sú elektrostatické sily
Ovplyvňujú makroskopické vlastnosti - objem, viskozitu, teploty varu, topenia, …
4 typy: (najsilnejšie -> najslabšie)
- Vodíkové väzby
- Dipólové sily
- Jónovo indukované dipólové sily
- Van der Waals sily - Keesom, Debye, London dispersion sily
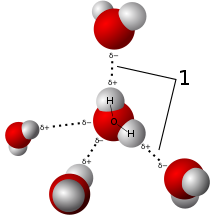
# Vodíkové väzby
Príťažlivá sila medzi H s $\delta+$ a atómom s VEP 1
Dn–H···Ac
Najčastejšie sa podieľajú na väzbe
kyslík (O),
dusík (N), flúor (F)
Sú to prvky z 2. periódy
# Dipólové sily
Dipól-dipól:
Elektrostatická interakcia dvoch permanentných dipólov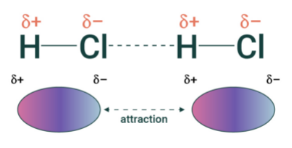
Jón-dipól:
Elektrostatická interakcia jónu a permanentného dipólu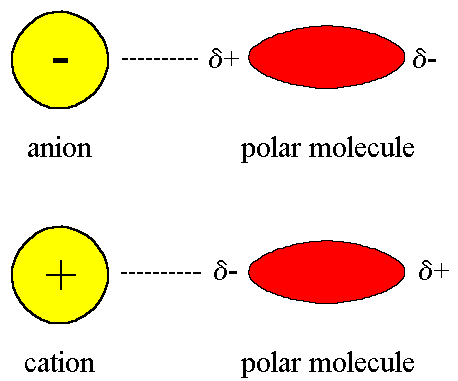
Jón-indukovaný dipól:
Elektrostatická interakcia jónu a jónom indukovaným dipólom
Dipól je indukovaný na originálne nepolárnej molekule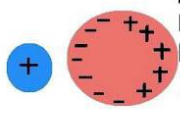
# Van der Waals sily
Sily medzi nepolárnymi molekulami či atómami
sú o dosť viac makroskopické -> univerzálna príťažlivosť medzi telesami (veľmi krátka vzdialenosť)
-> Keesom, Debye, London sily
London dispersion force:
Tvorené fluktuáciami a indukciami elektrického poľa v molekulách
Dva kroky: polarizácia a indukcia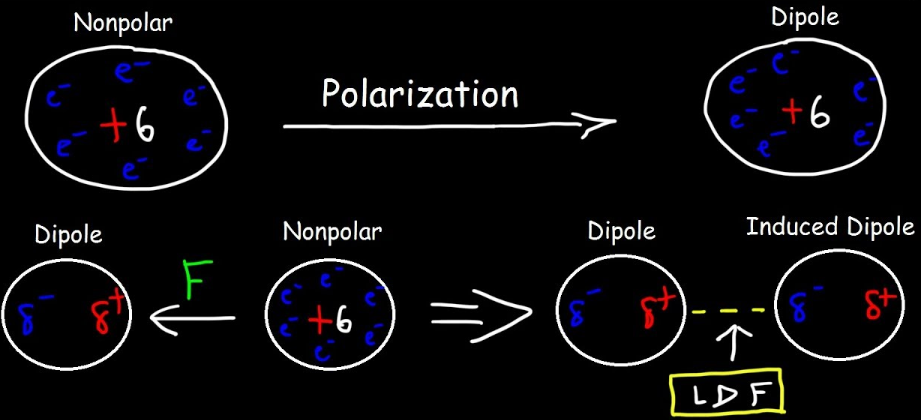
Voľný elektrónový pár ↩︎