Atómy
| Protón | Elektrón | Neutrón | |
|---|---|---|---|
| Náboj / C | $+1.602*10^{-19}$ | $+1.602*10^{-19}$ | 0 |
| Relatívny náboj | 1 | -1 | 0 |
| Hmotnosť / kg | $1.673*10^{-27}$ | $9.109*10^{-31}$ | $1.673*10^{-27}$ |
| Relatívna hmotnosť | 1837 | 1 | 1839 |
# Atómové čísla
$$^A_ZE, \qquad \text{A = nukleónové číslo, Z = protónové číslo}$$
Izotópy - atómy s rovnakým množstvom protónov a rozdielným počtom nukleónov
-> prirodzené prvky sa vyskytujú v zmesiach
Relatívna atómová hmotnosť: definovaná s jednotkami $u = 1/12*m(^{12}_6C) \approx m_\text{protón}$
# Alotrópy
-> Štruktúrne modifikácie prvkov do rôznych foriem molekúl
# Síra
Existuje vo viacerých formách, hlavne n-cykly a v limite reťazce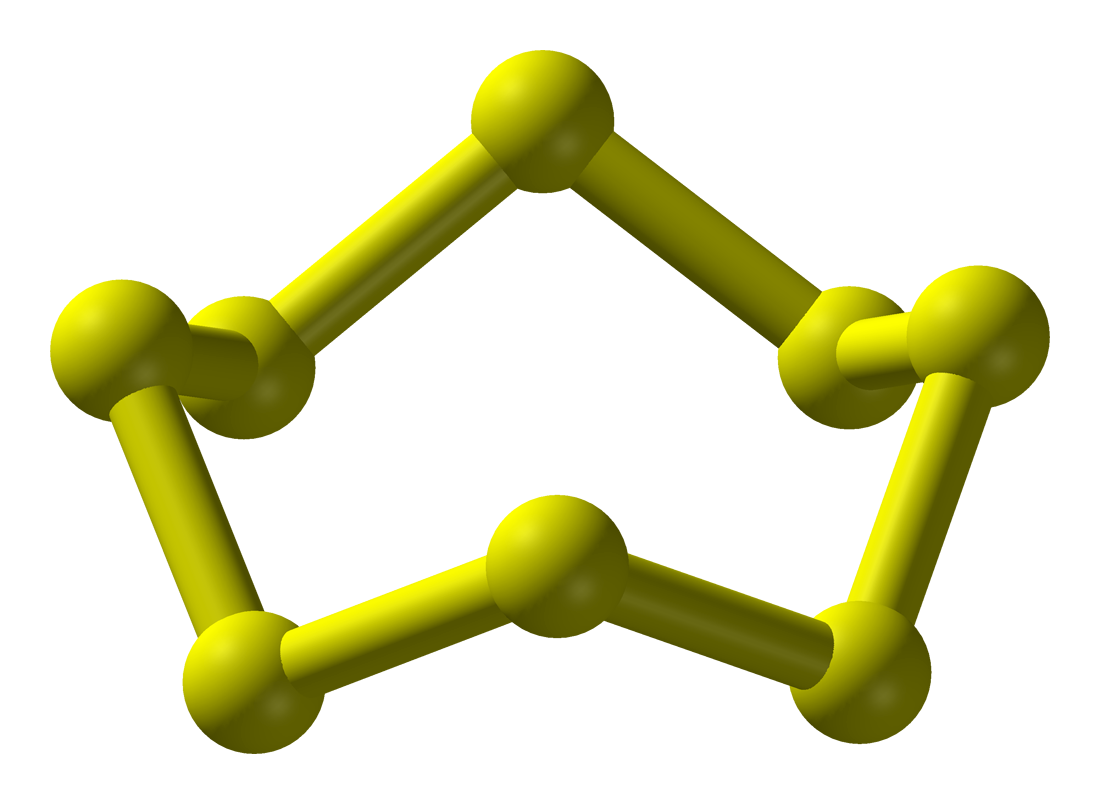
Špeciálne:
| Vzorec | Názov | Poznámky |
|---|---|---|
| S2 | disíra | A diatomic gas with a triplet ground state like dioxygen |
| S3 | trisíra | A cherry red triatomic gas with a bent ozone-like structure |
# Fosfor
3 hlavné alotrópy:
- biely fosfor $P_4$ (tetrafosfor)
- červený fosfor $P_n$ - dlhé reťazce tetrafosforu
- čierny fosfor - vrstevnatý
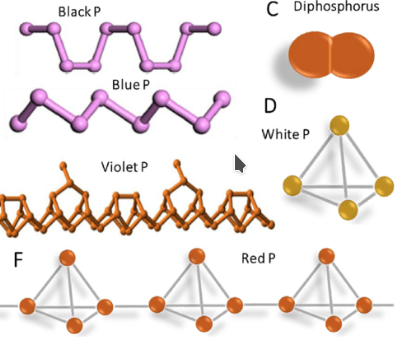
Najreaktívnejší = biely fosfor, pyroforický (samovznietivý), jedovatý, podlieha oxidácií:
$\ce{P4 ->[O2] P4O6}$ oxid fosforitý v dimérnej forme $\ce{->[O2] P4O10}$ oxid fosforečný v dimérnej forme
$\ce{P4O10 + 6H2O -> 4H3PO4}$ (hygroskopický, sušenie látok)
# Efektívny náboj
Príťažlíva sila pôsobiaca na valenčný elektrón
$$Z_{\text{eff}}=Z-S \qquad \text{Z = protónové číslo, S = počet vnútorných elektrónov}$$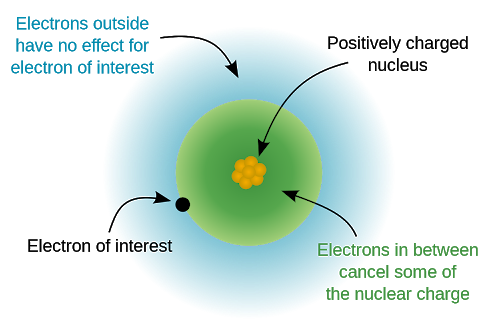
Stúpa vrámci periódy doprava, kvôli stúpajúcemu protónovému číslu
-> veľkosť elektrónového obalu klesá vrámci periódy